Jenis dan Contoh Reaksi Pengganti Double
The tindak balas penggantian berganda, daripada anjakan berganda atau metatesis, adalah satu di mana pertukaran ion berganda berlaku antara dua sebatian, tanpa pengoksidaan atau pengurangan ini. Ini adalah salah satu reaksi kimia yang paling asas.
Ikatan baru terbentuk oleh daya tarik elektrostatik yang besar antara ion. Juga, reaksi nikmat pembentukan spesies yang lebih stabil, seperti molekul air, terutamanya. Persamaan kimia umum untuk tindak balas penggantian berganda digambarkan dalam imej yang lebih rendah.
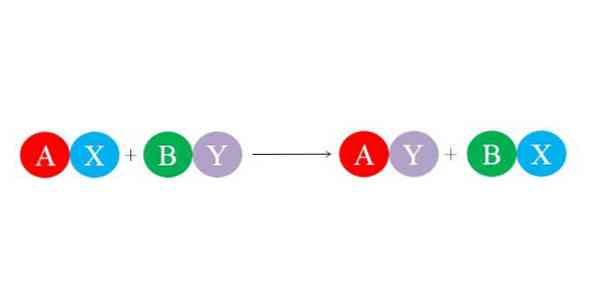
Sebatian awal AX dan BY bereaksi dengan bertukar "rakan kongsi mereka" dan dengan itu membentuk dua sebatian baru: AY dan BX. Reaksi ini berlaku jika dan hanya jika A dan Y lebih berkaitan daripada A dan B, atau jika pautan BX lebih stabil daripada OLEH. Oleh kerana tindak balas adalah pertukaran ion mudah, tiada satu pun keuntungan atau kehilangan elektron (reaksi redoks).
Oleh itu, jika A adalah kiriman caj +1 dalam kompaun AX, ia akan mempunyai caj yang sama +1 dalam kompaun AY. Perkara yang sama berlaku untuk "huruf" yang lain. Reaksi jenis ini adalah sokongan tindak balas asid dan pembentukan endapan.
Indeks
- 1 Jenis
- 1.1 Neutralisasi
- 1.2 Pemendakan
- 2 Contoh
- 2.1 Contoh 1
- 2.2 Contoh 2
- 2.3 Contoh 3
- 2.4 Contoh 4
- 2.5 Contoh 5
- 2.6 Contoh 6
- 2.7 Contoh 7
- 2.8 Contoh 8
- 3 Rujukan
Jenis
Neutralisasi
Asid kuat bertindak balas dengan asas yang kuat untuk menghasilkan garam larut dan air. Apabila salah satu daripada dua - asid atau pangkal - lemah, garam yang dihasilkan tidak sepenuhnya diionkan; iaitu, dalam medium berair mampu hidrolisis. Begitu juga, asid atau asas boleh dinetralkan dengan garam.
Di atas sekali lagi boleh diwakili oleh persamaan kimia dengan huruf AXBY. Walau bagaimanapun, kerana keasidan Brønsted ditunjukkan hanya oleh ion H+ dan OH-, ini datang untuk mewakili maka huruf A dan Y:
HX + BOH => HOH + BX
Persamaan kimia ini sepadan dengan peneutralan, yang merupakan reaksi antara asid HX dan pangkalan BOH untuk menghasilkan HOH (H2O) dan garam BX, yang mungkin atau tidak boleh larut dalam air.
Kerangka anda mungkin berbeza-beza mengikut pekali stoikiometrik atau sifat asid (sama ada organik atau tidak organik).
Pemendakan
Dalam tindak balas jenis ini salah satu produk tidak larut dalam medium, umumnya berair, dan berketul (pepejal memejal dari seluruh larutan).
Skim ini adalah seperti berikut: dua sebatian terlarut, AX dan OD, bercampur, dan salah satu produk, AY atau BX, merangsang, yang akan bergantung kepada peraturan kelarutan:
AX + BY => AY (s) + BX
AX + BY => AY + BX (s)
Dalam kes kedua-dua AY dan BX tidak larut dalam air, pasangan ion yang menunjukkan interaksi elektrostatik terkuat akan mendakan, yang dapat dilihat secara kuantitatif dalam nilai pemalar keterlarutannya (Kps).
Walau bagaimanapun, dalam kebanyakan reaksi hujan, satu garam boleh larut dan yang lain merambat. Kedua-dua tindak balas-peneutralan dan pemendakan-boleh berlaku dalam campuran bahan yang sama.
Contohnya
Contoh 1
HCl (ac) + NaOH (ac) => H2O (l) + NaCl (ac)
Apakah jenis tindak balas ini? Asid hidroklorik bertindak balas dengan natrium hidroksida, menghasilkan air dan natrium klorida sebagai akibatnya. Kerana NaCl sangat larut dalam medium berair, dan molekul air juga terbentuk, tindak balas contoh 1 ialah peneutralan.
Contoh 2
Cu (NO3)2(ac) + Na2S (ac) => CuS (s) + 2NaNO3(ac)
Dalam reaksi ini tidak ada H ion+ atau OH-, dan molekul air tidak diperhatikan di sebelah kanan persamaan kimia.
Tembaga (II) nitrat, atau nitrat kuprum, pertukaran ion dengan natrium sulfida. Tembaga sulfida tidak larut, merangsang, tidak seperti natrium nitrat, garam larut.
Penyelesaian Cu (NO3)2 Ia biru, sementara Na2S adalah kekuningan. Apabila kedua-dua bercampur warna hilang dan CuS mendahului, iaitu pepejal hitam.
Contoh 3
CH3COOH (ac) + NaOH (ac) => CH3COONa (ac) + H2O (l)
Sekali lagi, ini adalah reaksi peneutralan yang lain. Asid asetik bertindak balas dengan natrium hidroksida untuk membentuk garam natrium asetat dan molekul air.
Tidak seperti contoh 1, natrium asetat bukan garam yang terionisasi sepenuhnya, kerana anion itu dihidrolisiskan:
CH3COO-(ac) + H2O (l) <=> CH3COOH (ac) + OH-(ac)
Contoh 4
2HI (ac) + CaCO3(s) => H2CO3(ac) + CaI2(ac)
Dalam reaksi ini, yang walaupun tidak kelihatan meneutralkan, asid hidriodik bertindak balas sepenuhnya dengan batu kapur untuk menghasilkan asid karbonat dan kalsium iodida. Di samping itu, pelepasan haba (reaksi eksotermik) mengurai asid karbonik ke dalam karbon dioksida dan air:
H2CO3(ac) => CO2(g) + H2O (l)
Reaksi global kekal sebagai:
2HI (ac) + CaCO3(s) => CO2(g) + H2O (l) + CaI2(ac)
Juga, kalsium karbonat, garam asas, meneutralkan asid hidriodik.
Contoh 5
AgNO3(ac) + NaCl (ac) => AgCl (s) + NaNO3(ac)
Ion pertukaran nitrat perak dengan natrium klorida, dengan itu membentuk garam yang tidak larut dari perak klorida (mendakan putih) dan natrium nitrat.
Contoh 6
2H3PO4(ac) + 3Ca (OH)2(ac) => 6H2O (l) + Ca3(PO4)2(s)
Asid fosforik disatralkan oleh kalsium hidroksida, seterusnya membentuk kalsium fosfat garam dan enam molekul air molekul.
Ini adalah contoh reaksi penggantian berganda bagi kedua-dua jenis: peneutralan asid dan pemendapan garam yang tidak larut.
Contoh 7
K2S (ac) + MgSO4(ac) => K2SO4(ac) + MgS (s)
Kalium sulfida bereaksi dengan magnesium sulfat, ion S datang bersama-sama dalam larutan2- dan Mg2+ untuk membentuk magnesium sulfida garam yang tidak larut dan garam sulfat garam larut.
Contoh 8
Na2S (ac) + HCl (ac) → NaCl (ac) + H2S (g)
Natrium sulfida meneutralkan asid hidroklorik, menghasilkan natrium klorida dan hidrogen sulfida.
Dalam tindak balas ini tidak membentuk air (tidak seperti neutralisasi yang paling biasa) tetapi molekul hidrogen sulfida bukan elektrolitik, yang bau telur busuk sangat tidak menyenangkan. The H2S melepaskan pembubaran dalam bentuk gas dan seluruh spesies masih dibubarkan.
Rujukan
- Whitten, Davis, Peck & Stanley. Kimia (Ed ed.). CENGAGE Learning, p 150-155.
- Quimicas.net (2018). Contoh Reaksi Penggantian Ganda. Diperoleh pada 28 Mei 2018, dari: quimicas.net
- Reaksi Metatesis. Diperoleh pada 28 Mei 2018, dari: science.uwaterloo.ca
- Khan Academy. (2018). Reaksi penggantian berganda. Diperoleh pada 28 Mei 2018, dari: khanacademy.org
- Helmenstine, Anne Marie, Ph.D. (8 Mei 2016). Definisi Reaksi Penggantian Ganda. Diperoleh pada 28 Mei 2018, dari: thoughtco.com


