Proses, Jenis dan Contoh Reaksi Exothermic
The reaksi eksotermik adalah sejenis tindak balas kimia di mana pemindahan tenaga berlaku, terutamanya dalam bentuk haba atau pelepasan cahaya. Nama itu berasal dari awalan Yunani exo, yang bermaksud "di luar negara"; dan istilah "haba", yang merujuk kepada haba atau suhu.
Dalam pengertian ini, tindak balas eksotermik boleh memindahkan jenis tenaga lain ke persekitaran di mana ia dijana, seperti dengan letupan dan cara mereka memindahkan tenaga kinetik dan sonik apabila bahan-bahan yang berada dalam fasa gas pada suhu tinggi diperluaskan. cara yang ganas.
Dengan cara yang sama, dalam hal menggunakan bateri, tindak balas eksotermik juga dijalankan, hanya dalam hal ini tenaga elektrik diangkut.
Indeks
- 1 Proses
- 2 Jenis
- 2.1 tindak balas pembakaran
- 2.2 tindak balas neutralisasi
- 2.3 tindak balas pengoksidaan
- 2.4 reaksi rayap
- 2.5 Pempolimeran tindak balas
- 2.6 tindak balas pembelahan nuklear
- 2.7 tindak balas yang lain
- 3 Contoh
- 4 Rujukan
Proses
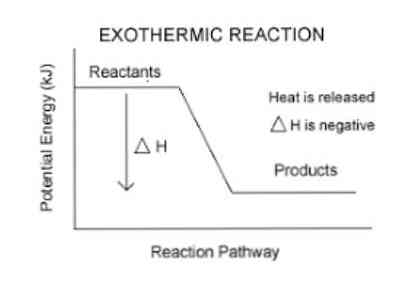
Sebelum ini, disebutkan bahawa apabila tindak balas eksotermik berlaku pelepasan tenaga berlaku, yang boleh digambarkan lebih mudah dalam persamaan berikut:
Reagen (s) → Produk (s) + Tenaga
Oleh itu, untuk mengukur tenaga yang diserap atau dikeluarkan oleh sistem, parameter termodinamik yang dipanggil entalpi (dilambangkan dengan "H") digunakan. Jika dalam sistem (dalam kes ini, tindak balas kimia) terdapat pelepasan tenaga ke persekitaran, maka perubahan entalpi (dinyatakan sebagai ΔH) akan mempunyai nilai negatif.
Jika tidak, jika variasi ukuran ini adalah positif, ia mencerminkan penyerapan haba dari persekitaran. Juga, magnitud perubahan entalpi sistem ialah ungkapan jumlah tenaga yang dipindahkan ke atau dari persekitaran.
Lebih besar magnitud ΔH, semakin besar pembebasan tenaga dari sistem ke medium sekitarnya.
Ini adalah kerana dalam reaksi ini, tenaga bersih yang dikeluarkan apabila pautan baru dicipta adalah lebih besar daripada tenaga bersih yang digunakan dalam pemecahan pautan.
Dari yang di atas, dapat disimpulkan bahawa tindak balas jenis ini sangat umum, kerana produk reaksi mempunyai jumlah tenaga yang disimpan dalam ikatan yang lebih besar daripada apa yang terkandung di dalam reaktan..
Jenis
Terdapat pelbagai jenis reaksi eksotermik dalam pelbagai bidang kimia, sama ada dalam makmal atau dalam industri; sesetengahnya dijalankan secara spontan dan yang lain memerlukan keadaan tertentu atau beberapa jenis bahan seperti pemangkin untuk dihasilkan.
Berikut adalah jenis reaksi eksoterm yang paling penting:
Tindak balas pembakaran
Reaksi pembakaran adalah jenis redoks yang terjadi apabila satu atau lebih bahan bereaksi dengan oksigen, secara amnya untuk menghasilkan pembebasan cahaya dan tenaga terma - cahaya, dan panas - apabila api dihasilkan..
Tindak balas peneutralan
Reaksi peneutralan dicirikan oleh interaksi antara spesies asid dan bahan alkali (asas) untuk membentuk garam dan air, yang menunjukkan sifat eksotermik.
Tindak balas pengoksidaan
Terdapat banyak tindak balas jenis ini yang menunjukkan tingkah laku eksotermik, kerana pengoksidaan oksigen menyebabkan pembebasan sejumlah besar tenaga, seperti yang berlaku dalam pengoksidaan hidrokarbon..
Reaksi rayap
Tindak balas ini dapat menghasilkan suhu kira-kira 3000 ° C, dan kerana pertalian tinggi serbuk aluminium dengan sejumlah besar oksida logam, ia digunakan dalam kimpalan keluli dan besi.
Tindak balas pempolimeran
Tindak balas jenis ini adalah yang berasal apabila sejumlah spesies kimia yang dipanggil monomer bertindak balas, iaitu unit yang apabila digabungkan diulang dalam rantai untuk membentuk struktur makromolekul yang dipanggil polimer.
Tindak balas pembelahan nuklear
Proses ini merujuk kepada pembahagian nukleus atom yang dianggap berat - iaitu, dengan bilangan massa (A) lebih besar daripada 200 - untuk menghasilkan serpihan atau nuklei saiz yang lebih kecil dengan jisim perantaraan.
Dalam tindak balas ini, di mana satu atau lebih neutron dibentuk, sejumlah besar tenaga dilepaskan kerana teras dengan berat yang lebih besar mempunyai kestabilan yang lebih rendah daripada produknya.
Reaksi lain
Terdapat juga tindak balas eksotermik lain yang relevan, seperti dehidrasi beberapa karbohidrat apabila bertindak balas dengan asid sulfurik, penyerapan air yang mempunyai natrium hidroksida yang terdedah kepada udara terbuka atau pengoksidaan spesies logam dalam banyak tindak balas kakisan.
Contohnya
Berikut adalah beberapa contoh reaksi eksotermik, yang menghasilkan variasi entalpi yang mempunyai nilai negatif kerana fakta bahawa mereka melepaskan tenaga, seperti yang disebutkan di atas..
Sebagai contoh, pembakaran propana adalah tindak balas eksotermik spontan:
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O (l)
Satu lagi kes tingkah laku eksotermik ditunjukkan oleh tindak balas peneutralan antara natrium karbonat dan asid hidroklorik:
NaHCO3(ac) + HCl (ac) → NaCl (ac) + H2O (l) + CO2(g)
Pengoksidaan etanol kepada asid asetik yang digunakan dalam breathalyzers juga dibentangkan, yang reaksi lengkap ditunjukkan dalam persamaan berikut:
3CH3CH2OH + 2K2Cr2O7 + 8H2SO4 → CH3COOH + 2Cr (SO4)3 + 2K2SO4 + 11H2O
Satu lagi reaksi eksotermik adalah tindak balas termite yang disebut, di mana aluminium digabungkan dengan oksida logam, seperti yang dicontohkan di bawah:
2Al (s) + Iman2O3(s) → Al2O3(s) + Fe (l)
Sebagai tambahan kepada contoh-contoh yang dijelaskan di atas, terdapat pelbagai reaksi yang juga dianggap sebagai eksotermik, seperti penguraian beberapa bahan buangan organik untuk pengkomposan..
Ia juga menyerlahkan pengoksidaan pigmen luciferin dengan tindakan luciferase enzim untuk menghasilkan ciri-ciri bioluminescence kunang-kunang, dan juga bernafas, di antara banyak reaksi lain.
Rujukan
- Wikipedia. (s.f.). Reaksi eksotermik. Diambil dari es.wikipedia.org
- BBC (s.f.). Perubahan tenaga dan tindak balas boleh balik. Diperolehi daripada bbc.co.uk
- Chang, R. (2007). Kimia, Edisi kesembilan. (McGraw-Hill).
- Walker, D. (2007). Reaksi Kimia. Diperoleh dari books.google.com
- Saunders, N. (2007). Meneroka Reaksi Kimia. Diperoleh dari books.google.com


