Apa itu Pewarnaan Mudah? Ciri-ciri Teratas
The pewarnaan mudah adalah prosedur pewarnaan yang cepat dan mudah di mana pewarna tunggal digunakan, itulah sebabnya ia dipanggil mudah. Ia digunakan terutamanya untuk menentukan morfologi dan organisasi sel yang terdapat di dalam sampel.
Sememangnya sel-sel tidak mempunyai warna, jadi ia perlu membuatnya kelihatan dalam beberapa cara apabila ia diperhatikan dalam mikroskop.
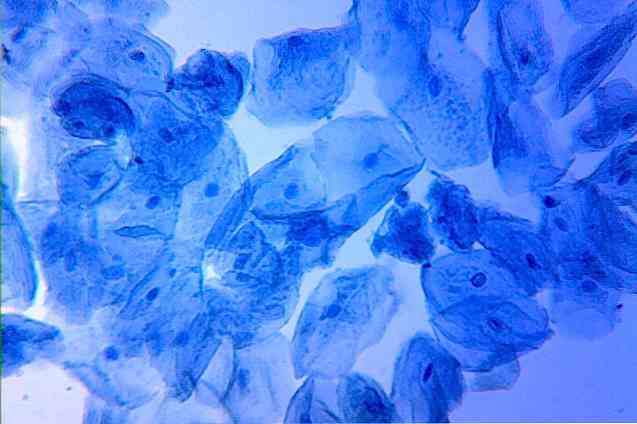
Adalah penting untuk menekankan bahawa pewarna yang digunakan dalam pewarnaan mudah mesti asas dengan caj positif (kationik), supaya mereka boleh secara spontan mengikat dinding sel dan sitoplasma.
Struktur selular ini dikenakan caj negatif. Inilah sebabnya mengapa pewarna, yang dikenakan secara positif, tertarik kepada sel dan mengikatnya secara spontan. Oleh itu, semua sel yang hadir dalam sampel berwarna dengan cepat.
Pewarna digunakan dalam pewarnaan mudah
Terdapat beberapa pewarna asas yang boleh digunakan dalam makmal mikrobiologi. Yang paling banyak digunakan ialah:
- Biru metilena.
- Violet kristal.
- Hijau malachite.
- Fuchsin asas.
Semua pewarna ini berfungsi dengan baik dalam bakteria kerana mereka mempunyai ion berwarna (kationik) positif (chromophores).
Masa pewarnaan untuk kebanyakan pewarna ini agak pendek. Mereka biasanya terdiri daripada 30 saat hingga 2 minit, bergantung kepada pertalian pewarna tersebut.
Adalah penting untuk diingat bahawa sebelum pencelupan sampel dengan pewarnaan mudah, ia mesti dilanjutkan dan tetap ke slaid kaca (slaid); Sampel yang diperluaskan dan tetap dipanggil smear.
6 langkah untuk melakukan pewarnaan mudah
Langkah 1
Letakkan slaid pada rak pewarna dan gunakan pewarna yang dikehendaki. Tinggalkan masa yang sepadan.
Biasanya, pewarnaan mudah mengambil beberapa saat atau beberapa minit, bergantung kepada pewarna yang digunakan.
Pemerhatian
Dalam langkah ini adalah penting untuk tidak melebihi masa yang disyorkan untuk pewarna yang digunakan, kerana kristal boleh membentuk lembaran, menghasilkan apa yang dikenali sebagai "artifak" yang mengganggu morfologi sel.
Langkah 2
Berhati-hati mencuci smear slaid dengan air suling dari botol, atau juga dengan air paip yang mengalir perlahan-lahan, sehingga larian menjadi telus. Ini biasanya mengambil masa 5 hingga 10 saat.
Pemerhatian
Jangan gunakan aliran air secara langsung di atas smear, untuk mengelakkan daya yang sama daripada merosakkan sampel.
Jika anda tidak mempunyai air suling, anda boleh menggunakan air paip tanpa apa-apa masalah kerana ia tidak akan menjejaskan hasil pewarnaan.
Langkah 3
Keringkan slaid dengan tuala kertas penyerap dalam satu arah dan tanpa menggosok. Pastikan bahagian bawah slaid bersih.
Langkah 4
Perhatikan smear berwarna dalam mikroskop. Mulakan dengan matlamat yang paling jauh untuk mencari lokasi yang betul untuk melihat dengan lebih terperinci. Tukar objektif untuk mendekati dan mendekati sampel.
Pemerhatian
Untuk penggunaan kanta dengan perbesaran tertinggi (biasanya 100X), minyak rendaman harus digunakan, kerana ia membantu cahaya menembusi lebih baik dan imej menjadi lebih tajam. Ia tidak perlu menggunakan coverlip.
Langkah 5
Akhirnya, buang semua sampel dalam bekas yang betul yang betul dilabelkan sebagai "biohazard".
Rujukan
- (2001). Aplikasi Mikrobiologi: Manual Makmal di Mikrobiologi Umum (8 th ed.). Syarikat McGraw-Hill.
- Harisha, S. (2006). Pengenalan kepada Bioteknologi Praktikal (1st). Media Firewall.
- Moyes, R. B., Reynolds, J., & Breakwell, D. P. (2009). Pewarnaan awal bakteria: Noda mudah. Protokol Semasa dalam Mikrobiologi, (SUPPL 15), 1-5.
- Pommerville, J. (2013). Asas Makmal Mikrobiologi Alcamo (10th). Pembelajaran Jones & Bartlett.
- Prescott, H. (2002). Latihan Makmal Mikrobiologi (5 th). Syarikat McGraw-Hill.
- Sumbali, G. & Mehrotra, R. (2009). Prinsip-prinsip Mikrobiologi (1st). Pendidikan Tata McGraw-Hill.


