Karbon dalam alam semula jadi di mana ia dijumpai dan bagaimana, sifat, kegunaan
The bersifat karbon ia boleh didapati di berlian, minyak dan grafiti, di antara banyak senario lain. Unsur kimia ini menempati tempat keenam dalam jadual berkala dan terletak pada baris mendatar atau tempoh 2 dan lajur 14. Ia bukan logam dan tetravalen; iaitu, anda boleh menubuhkan 4 ikatan kimia elektron bersama atau ikatan kovalen.
Karbon adalah unsur dengan kelimpahan terbesar di kerak bumi. Kelimpahan ini, kepelbagaian yang unik dalam pembentukan sebatian organik dan keupayaannya yang luar biasa untuk membentuk makromolekul atau polimer pada suhu yang biasa dijumpai di Bumi, menjadikannya berfungsi sebagai elemen umum bagi semua bentuk kehidupan yang diketahui.

Karbon wujud secara alamiah sebagai unsur kimia tanpa menggabungkan dalam bentuk grafit dan berlian. Walau bagaimanapun, sebahagian besarnya digabungkan untuk membentuk sebatian karbon kimia, seperti kalsium karbonat (CaCO).3) dan sebatian lain dalam petroleum dan gas asli.
Ia juga membentuk beberapa mineral seperti antrasit, arang batu, lignit dan gambut. Kepentingan karbon yang paling penting adalah ia membentuk "blok kehidupan" yang dipanggil dan terdapat dalam semua organisma hidup.
Indeks
- 1 Di mana karbon dijumpai dan dalam bentuk apa?
- 1.1 Bentuk Kristal
- 1.2 Borang amorfus
- 1.3 Minyak, gas asli dan bitumen
- 2 Sifat fizikal dan kimia
- 2.1 Simbol kimia
- 2.2 Nombor atom
- 2.3 Negeri fizikal
- 2.4 Warna
- 2.5 Jisim atom
- 2.6 Takat lebur
- 2.7 Titik didih
- 2.8 Ketumpatan
- 2.9 Kelarutan
- 2.10 konfigurasi elektronik
- 2.11 Bilangan elektron dalam lapisan luar atau valensi
- 2.12 Kapasiti pautan
- 2.13 Catenación
- 3 Kitaran biogeokimia
- 3.1 Photosynthesis
- 3.2 Pernafasan dan penguraian
- 3.3 Proses geologi
- 3.4 Gangguan aktiviti manusia
- 4 Kegunaan
- 4.1 Minyak dan gas asli
- 4.2 Grafit
- 4.3 Diamond
- 4.4 Anthracite
- 4.5 Arang batu keras
- 4.6 Lignite
- 4.7 Gambut
- 5 Rujukan
Di mana karbon dijumpai dan dalam bentuk apa?
Sebagai tambahan kepada komponen kimia biasa untuk semua bentuk kehidupan, alam semula jadi karbon terdapat dalam tiga bentuk kristal: berlian, grafit dan fullerene.
Terdapat juga beberapa bentuk mineral arang batu (antrasit, lignit, arang batu, gambut), bentuk cecair (jenis minyak) dan soda (gas asli).
Bentuk kristal
Dalam bentuk kristal, atom karbon bergabung membentuk corak yang disusun dengan susunan spatial geometri.
Grafit
Ia adalah pepejal lembut warna hitam dengan kilau atau bersinar logam dan tahan panas (refraktori). Struktur kristalnya membentangkan atom karbon yang menyertai cincin heksagon yang, pada gilirannya, bergabung bersama membentuk lembaran.
Deposit grafit adalah terhad dan telah dijumpai di China, India, Brazil, Korea Utara dan Kanada.
Berlian
Ia adalah pepejal yang sangat keras, telus kepada cahaya dan lebih padat daripada grafit: nilai ketumpatan berlian adalah sama dengan hampir dua kali ganda daripada grafit.
Atom karbon dalam berlian menyertai geometri tetrahedral. Begitu juga, berlian terbentuk daripada grafit tertakluk kepada keadaan suhu dan tekanan yang sangat tinggi (3000 °C dan 100 000 atm).
Kebanyakan berlian terletak antara 140 dan 190 km jauh di dalam mantel. Melalui letusan gunung berapi yang mendalam, magma dapat mengangkut mereka ke jarak dekat dengan permukaan.
Terdapat bidang berlian di Afrika (Namibia, Ghana, Republik Demokratik Congo, Sierra Leone dan Afrika Selatan), Amerika (Brazil, Colombia, Venezuela, Guyana, Peru), Oceania (Australia) dan Asia (India).

Fulerenos
Mereka adalah bentuk molekul karbon yang membentuk kelompok 60 dan 70 atom karbon dalam molekul hampir sfera, sama dengan bola sepak.
Terdapat juga fullerenes lebih kecil daripada 20 atom karbon. Sesetengah bentuk fullerenes termasuk nanotube karbon dan gentian karbon.

Bentuk amorfus
Dalam bentuk amorf, atom karbon tidak bersatu, membentuk struktur kristal teratur dan teratur. Sebaliknya, mereka juga mengandungi kekotoran dari elemen lain.
Anthracite
Ia adalah arang batu metamorf yang tertua (yang berasal dari pengubahsuaian batu oleh kesan suhu, tekanan atau tindakan kimia cecair), sejak tarikh pembentukannya dari era utama atau Paleozoik, tempoh Karbon.
Anthracite adalah bentuk karbon amorf yang mempunyai kandungan yang lebih tinggi dari elemen ini: antara 86 dan 95%. Ia adalah gloss hitam kelabu dan logam, dan ia adalah berat dan padat.
Secara amnya, antrasit didapati dalam bidang ubah bentuk geologi dan merupakan kira-kira 1% daripada rizab arang batu dunia.
Secara geografi ia ditemui di Kanada, AS, Afrika Selatan, Perancis, Inggeris, Jerman, Rusia, China, Australia dan Colombia.

Arang keras
Ia adalah batu arang batu, batu sedimen asal organik, yang mana tarikh pembentukannya dari era Paleozoic dan Mesozoik. Ia mempunyai kandungan karbon antara 75 dan 85%.
Ia berwarna hitam, ia dicirikan oleh legap dan mempunyai penampilan yang matang dan berminyak, kerana ia mempunyai kandungan bitumen yang tinggi. Ia terbentuk dengan pemampatan lignit dalam era Paleozoic, dalam tempoh Carboniferous dan Permian.
Ia adalah bentuk arang batu yang paling melimpah di planet ini. Terdapat simpanan arang batu yang besar di Amerika Syarikat, Great Britain, Jerman, Rusia dan China.
Lignite
Ia adalah arang batu fosil yang terbentuk dalam usia tertua dari gambut oleh mampatan (tekanan tinggi). Ia mempunyai kandungan karbon yang lebih rendah daripada arang batu, antara 70 dan 80%.
Ia adalah bahan yang agak ringkas, rapuh (ciri-ciri yang membezakannya daripada mineral karbon lain), coklat atau hitam. Teksturnya sama dengan kayu dan kandungan karbonnya dari 60 hingga 75%.
Ia adalah bahan api pencucuhan yang mudah, dengan nilai kalori yang rendah dan kandungan air yang lebih rendah daripada gambut.
Terdapat lombong lignit penting di Jerman, Rusia, Republik Czech, Itali (wilayah Veneto, Tuscany, Umbria) dan Sardinia. Di Sepanyol, deposit lignit berada di Asturias, Andorra, Zaragoza dan La Coruña.
Gambut
Ia adalah bahan asal organik yang pembentukannya berasal dari era Kuarter, lebih baru-baru ini berbanding dengan arang sebelumnya.
Ia berwarna kuning kecoklatan dan muncul sebagai jisim spongy berkepadatan rendah, di mana anda dapat melihat tumbuhan kekal dari tempat asalnya.
Tidak seperti arang yang disebut di atas, gambut tidak berasal daripada proses pengkarbonisasi bahan kayu atau kayu, tetapi telah dibentuk oleh pengumpulan tumbuh-tumbuhan-pokok-pokok herba dan lumut-di kawasan-kawasan yang melanda melalui proses pengkarbonisasi yang belum selesai..
Gambut mempunyai kandungan air yang tinggi; untuk sebab ini ia memerlukan pengeringan dan pemadatan sebelum digunakan.
Ia mempunyai kandungan karbon rendah (hanya 55%); Oleh itu, ia mempunyai nilai tenaga yang rendah. Apabila tertakluk kepada pembakaran, residu abu adalah banyak dan memancarkan banyak asap.
Ada simpanan gambut penting di Chile, Argentina (Tierra del Fuego), Sepanyol (Espinosa de Cerrato, Palencia), Jerman, Denmark, Belanda, Rusia, Perancis.

Minyak, gas asli dan bitumen
Minyak (dari bahasa Latin petrae, yang bermaksud "batu"; dan oleum, yang bermaksud "minyak": "minyak batu") adalah campuran banyak sebatian organik - kebanyakan hidrokarbon - dihasilkan oleh penguraian bakteria anaerobik (tanpa oksigen) bahan organik.
Ia terbentuk di bawah tanah, di kedalaman yang besar dan di bawah keadaan khas kedua-dua fizikal (tekanan tinggi dan suhu) dan kimia (kehadiran sebatian katalis tertentu) dalam proses yang mengambil masa berjuta-juta tahun.
Semasa proses ini, C dan H dibebaskan dari tisu organik dan bergabung semula untuk merombak semula, membentuk sejumlah besar hidrokarbon yang bercampur sesuai dengan sifatnya, membentuk gas asli, minyak dan aspal.
Bidang minyak planet ini terletak terutamanya di Venezuela, Arab Saudi, Iraq, Iran, Kuwait, Emiriah Arab Bersatu, Rusia, Libya, Nigeria dan Kanada.
Terdapat rizab gas asli di Rusia, Iran, Venezuela, Qatar, Amerika Syarikat, Arab Saudi dan Emiriah Arab Bersatu, antara lain.
Sifat fizikal dan kimia
Di antara sifat-sifat karbon kita boleh menyebut perkara berikut:
Simbol kimia
C.
Nombor atom
6.
Keadaan fizikal
Pepejal, dalam keadaan normal tekanan dan suhu (1 suasana dan 25 °C).
Warna
Kelabu (grafit) dan telus (berlian).
Jisim atom
12,011 g / mol.
Titik lebur
500 °C.
Titik didih
827 °C.
Ketumpatan
2.62 g / cm3.
Kelarutan
Tidak larut dalam air, larut dalam karbon tetrachloride CCl4.
Konfigurasi elektronik
1s2 2s2 2p2.
Bilangan elektron dalam lapisan luar atau valens
4.
Kapasiti pautan
4.
Catenation
Ia mempunyai keupayaan untuk membentuk sebatian kimia dalam rantai panjang.
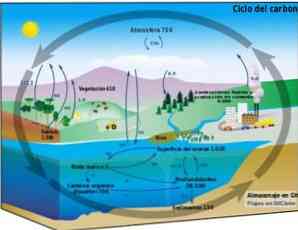
Kitaran biogeokimia
Kitaran karbon adalah proses biogeokimia bulat di mana karbon boleh ditukar antara biosfera, atmosfera, hidrosfera dan litosfera terestrial.
Pengetahuan tentang proses karbon siklik ini di Bumi memungkinkan untuk menunjukkan tindakan manusia terhadap kitaran ini dan akibatnya terhadap perubahan iklim global.
Karbon boleh beredar antara lautan dan badan air lain, serta antara litosfera, dalam tanah dan tanah bawah, di atmosfera dan di biosfera. Di atmosfera dan hidrosfera, karbon wujud dalam bentuk gas seperti CO2 (karbon dioksida).
Fotosintesis
Karbon di atmosfera ditangkap oleh organisma terestrial dan akuatik ekosistem (organisme fotosintesis).
Fotosintesis membolehkan tindak balas kimia antara CO berlaku2 dan air, yang ditengah oleh tenaga solar dan klorofil daripada tumbuhan, menghasilkan karbohidrat atau gula. Proses ini mengubah molekul mudah dengan kandungan tenaga CO rendah2, H2O dan oksigen O2, dalam bentuk molekul kompleks tenaga yang tinggi, iaitu gula.
Organisme heterotrophik - yang tidak dapat menjalankan fotosintesis dan yang merupakan pengguna dalam ekosistem - mendapatkan karbon dan tenaga apabila memberi makan kepada mereka pengeluar dan pengguna lain.
Pernafasan dan penguraian
Pernafasan dan penguraian adalah proses biologi yang melepaskan karbon ke alam sekitar dalam bentuk CO2 atau CH4 (metana yang dihasilkan dalam penguraian anaerobik, iaitu, jika tiada oksigen).
Proses geologi
Oleh geologi dan sebagai hasil daripada proses dari masa ke masa, penguraian anaerobik karbon boleh diubah menjadi bahan api fosil seperti minyak, gas asli dan arang batu. Begitu juga, karbon juga merupakan sebahagian daripada mineral dan batu lain.
Gangguan aktiviti manusia
Apabila manusia menggunakan pembakaran bahan api fosil untuk tenaga, karbon itu kembali ke atmosfera dalam bentuk sejumlah besar CO2 yang tidak boleh diasimilasikan oleh kitaran biogeokimia karbon semulajadi.
CO yang berlebihan ini2 yang dihasilkan oleh aktiviti manusia memberi kesan negatif terhadap keseimbangan kitaran karbon dan merupakan penyebab utama pemanasan global.
Kegunaan
Penggunaan karbon dan sebatiannya amat berbeza. Paling cemerlang dengan yang berikut:
Minyak dan gas asli
Penggunaan ekonomi utama karbon diwakili dalam penggunaannya sebagai hidrokarbon bahan bakar fosil, seperti gas metana dan petroleum..
Minyak disuling dalam penapisan untuk mendapatkan pelbagai derivatif seperti petrol, diesel, minyak tanah, asfalt, pelincir, pelarut dan lain-lain, yang seterusnya digunakan dalam industri petrokimia mengeluarkan bahan-bahan mentah untuk plastik, baja, farmaseutikal dan cat antara lain.
Grafit
Grafit digunakan dalam tindakan berikut:
- Ia digunakan dalam pembuatan pensil, dicampur dengan tanah liat.
- Ia adalah sebahagian daripada pembuatan batu bata refraktori dan crucibles, tahan haba.
- Dalam pelbagai peralatan mekanik seperti pencuci, bantalan, piston dan gasket.
- Ia adalah pelincir pepejal yang sangat baik.
- Kerana kekonduksian elektrik dan inertness kimianya, ia digunakan dalam pembuatan elektrod, arang motor elektrik.
- Ia digunakan sebagai moderator di loji tenaga nuklear.
Berlian
Diamond mempunyai ciri-ciri fizikal yang luar biasa, seperti tahap kekerasan yang lebih tinggi dan kekonduksian termal yang diketahui sehingga kini.
Ciri-ciri ini membolehkan aplikasi perindustrian dalam alat yang digunakan untuk membuat luka dan instrumen penggilap untuk kegagalan yang tinggi.
ciri-ciri optik seperti ketelusan dan keupayaan untuk memecahkan cahaya putih dan membiaskan cahaya-memberi banyak aplikasi dalam alat optik, dan pembuatan kanta dan prisma.
Kecerahan ciri yang diperolehi daripada sifat optiknya juga sangat dihargai dalam industri perhiasan.
Anthracite
Anthracite mengalami kesukaran membakar, pembakaran perlahan dan memerlukan banyak oksigen. Pembakarannya menghasilkan sedikit warna biru pucat dan pelepasan banyak haba.
Beberapa tahun yang lalu, antrasit digunakan di loji termoelektrik dan pemanasan domestik. Penggunaannya mempunyai kelebihan seperti pengeluaran abu atau debu sedikit, asap kecil dan proses pembakaran perlahan.
Disebabkan kos ekonomi yang tinggi dan kekurangannya, antrasit telah digantikan oleh gas asli di loji termoelektrik dan oleh kuasa elektrik di rumah.
Arang keras
Batu arang digunakan sebagai bahan mentah untuk mendapatkan:
- Coke, bahan api dari relau letupan di kilang keluli.
- Creosote, yang diperoleh dengan mencampurkan distilasi tar dari arang batu keras dan digunakan sebagai pelindung untuk melindungi kayu yang terdedah kepada cuaca.
- Cresol (kimia metilfenol) yang diekstrak daripada arang batu dan digunakan sebagai penyingkiran dan antiseptik,
- Derivatif lain seperti gas, tar atau padang, dan sebatian yang digunakan dalam pembuatan minyak wangi, racun serangga, plastik, cat, tayar dan laluan jalan, antara lain.
Lignite
Lignite mewakili bahan api berkualiti sederhana. Jet, pelbagai lignit, dicirikan dengan sangat padat oleh proses pengkarbonan yang panjang dan tekanan tinggi, dan digunakan dalam perhiasan dan hiasan.
Gambut
Gambut digunakan dalam aktiviti berikut;
- Untuk pertumbuhan, sokongan dan pengangkutan spesies tumbuhan.
- Sebagai baja organik.
- Sebagai katil haiwan dalam kandang.
- Sebagai bahan api berkualiti rendah.
Rujukan
- Burrows, A., Holman, J., Parsons, A., Pilling, G. dan Price, G. (2017). Kimia3: Memperkenalkan Kimia Bukan Organik, Organik dan Fizikal. Oxford University Press.
- Deming, A. (2010). Raja unsur-unsur? Nanoteknologi 21 (30): 300201. doi: 10.1088
- Dienwiebel, M., Verhoeven, G., Pradeep, N., Frenken, J., Heimberg, J. dan Zandbergen, H. (2004). Superlubricity of Graphite. Surat Pemeriksaan Fizikal. 92 (12): 126101. doi: 10.1103
- Irifune, T., Kurio, A., Sakamoto, S., Inoue, T. dan Sumiya, H. (2003). Bahan: Ultrahard polycrystalline diamond from graphite. Alam 421 (6923): 599-600. doi: 10.1038
- Savvatimskiy, A. (2005). Pengukuran titik lebur grafit dan sifat-sifat karbon cecair (ulasan untuk 1963-2003). Karbon. 43 (6): 1115. doi: 10.1016


