Mengimbangi Kaedah dan Contoh Persamaan Kimia
The mengimbangi persamaan kimia menunjukkan bahawa semua unsur yang ada dalam persamaan tersebut mempunyai bilangan atom yang sama di setiap sisi. Untuk mencapai matlamat ini, perlu menggunakan kaedah mengimbangi untuk menetapkan koefisien stoikiometrik yang sesuai untuk setiap spesies yang hadir dalam reaksi.
Persamaan kimia adalah perwakilan, dengan cara simbol, tentang apa yang berlaku dalam tindak balas kimia antara dua atau lebih bahan. Reaktan berinteraksi antara satu sama lain dan, bergantung kepada keadaan reaksi, satu atau lebih sebatian yang berbeza akan diperoleh sebagai produk..
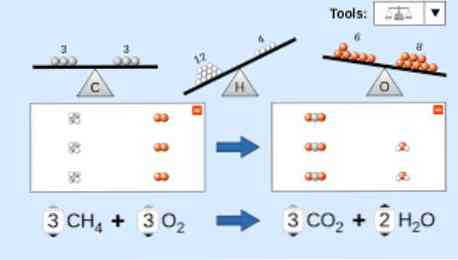
Apabila menggambarkan persamaan kimia, berikut mesti diambil kira: Pertama, bahan reaktan ditulis di sebelah kiri persamaan, diikuti oleh anak panah satu arah atau dua anak panah mendatar yang berlawanan, bergantung kepada jenis tindak balas yang dilakukan. tanjung.
Indeks
- 1 Kaedah mengimbangi persamaan kimia
- 1.1 Imbangan persamaan kimia oleh percubaan dan kesilapan (juga dikenali sebagai pemeriksaan atau percubaan)
- 1.2 Algebraik mengimbangi persamaan kimia
- 1.3 Rolling persamaan redoks (kaedah ion-elektron)
- 2 Contoh persamaan kimia yang mengimbangi
- 2.1 Contoh pertama
- 2.2 Contoh kedua
- 2.3 Contoh ketiga
- 3 Rujukan
Kaedah mengimbangi persamaan kimia
Mengambil sebagai asas bahawa reaktan dan produk diketahui, dan formula mereka dinyatakan dengan betul di sebelah yang sepadan dengannya, kami meneruskan untuk mengimbangi persamaan mengikut kaedah berikut.
Mengimbangi persamaan kimia oleh percubaan dan kesilapan (juga dikenali sebagai pemeriksaan atau percubaan)
Ia didasarkan pada stoikiometri tindak balas dan cuba untuk cuba dengan pekali yang berbeza untuk mengimbangi persamaan, selagi bilangan keseluruhan terkecil mungkin dipilih dengan jumlah atom yang sama setiap elemen diperolehi di kedua sisi tindak balas.
Pekali reaktan atau produk adalah nombor yang mendahului formulanya, dan ia adalah satu-satunya nombor yang boleh diubah apabila mengimbangi persamaan, kerana menukar subskrip formula akan mengubah identiti sebatian dalam soalan.
Kira dan bandingkan
Setelah mengenal pasti setiap elemen tindak balas dan meletakkannya pada bahagian yang betul, kita teruskan untuk mengira dan membandingkan bilangan atom setiap elemen yang ada dalam persamaan dan menentukan mereka yang mesti seimbang.
Kemudian, kita teruskan dengan mengimbangi setiap elemen (satu demi satu), dengan meletakkan keseluruhan koefisien sebelum setiap formula yang mengandungi elemen tidak seimbang. Biasanya unsur-unsur logam seimbang terlebih dahulu, maka elemen bukan logam dan akhirnya atom oksigen dan hidrogen.
Dengan cara ini, setiap pekali mengalikan semua atom formula terdahulu; jadi ketika mengimbangi elemen yang lain boleh tidak seimbang, tetapi ini diperbetulkan kerana reaksi seimbang.
Akhirnya, ia disokong oleh kiraan terakhir bahawa persamaan keseluruhannya betul seimbang, iaitu, ia mematuhi undang-undang pemuliharaan perkara.
Keseimbangan algebra dari persamaan kimia
Untuk menggunakan kaedah ini, satu prosedur ditubuhkan untuk merawat pekali persamaan kimia sebagai tidak diketahui sistem yang mesti diselesaikan..
Pertama, elemen tertentu tindak balas diambil sebagai rujukan dan koefisien diletakkan sebagai huruf (a, b, c, d ...), yang mewakili tidak diketahui, mengikut atom-atom yang ada unsur tersebut dalam setiap molekul (jika spesis tidak mengandungi elemen yang diletakkan "0").
Selepas memperoleh persamaan pertama ini, persamaan untuk unsur-unsur lain yang hadir dalam reaksi ditentukan; akan terdapat banyak persamaan kerana terdapat unsur-unsur dalam tindak balas tersebut.
Akhirnya, tak diketahui ditentukan oleh salah satu kaedah aljabar untuk pengurangan, penyamaan atau penggantian dan pekali diperoleh yang menghasilkan persamaan yang seimbang.
Mengimbangi persamaan redoks (kaedah ion-elektron)
Pertama tindak balas umum (tidak seimbang) diletakkan dalam bentuk ioniknya. Kemudian persamaan ini dibahagikan kepada dua separuh reaksi, pengoksidaan dan pengurangan, masing-masing mengimbangi mengikut bilangan atom, jenis mereka dan caj-caj ini.
Sebagai contoh, bagi tindak balas yang berlaku dalam medium asid, molekul H ditambah.2Atau untuk mengimbangi atom oksigen dan tambah H+ untuk mengimbangi atom hidrogen.
Sebaliknya, dalam medium alkali, jumlah ion OH yang sama ditambah- di kedua-dua belah persamaan untuk setiap H ion+, dan di mana ion H muncul+ dan OH- mereka bersatu untuk membentuk molekul H2O.
Tambah elektron
Kemudian anda mesti menambah seberapa banyak elektron yang perlu untuk mengimbangi caj, selepas mengimbangi perkara itu dalam setiap reaksi separuh.
Berikutan pengaliran setiap reaksi separuh, ini ditambah dan berakhir dengan mengimbangi persamaan akhir oleh percubaan dan kesilapan. Sekiranya terdapat perbezaan dalam bilangan elektron bagi dua reaksi separuh, satu atau kedua mesti didarabkan oleh pekali yang sama dengan nombor ini.
Akhirnya, ia mesti disokong bahawa persamaan itu merangkumi bilangan atom yang sama dan jenis atom yang sama, selain mempunyai caj yang sama di kedua-dua belah persamaan global.
Contoh persamaan kimia yang mengimbangi
Contoh pertama
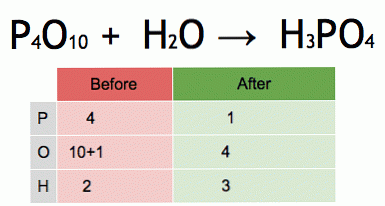
Ini adalah animasi persamaan kimia yang seimbang. Phosphorus pentoxide dan air ditukar kepada asid fosforik.
P4O10 + 6 H2O → 4 H3PO4 (-177 kJ).
Contoh kedua
Anda mempunyai tindak balas pembakaran ethane (tidak seimbang).
C2H6 + O2 → CO2 + H2O
Dengan menggunakan kaedah percubaan dan kesilapan untuk mengimbanginya, diperhatikan bahawa tiada elemen mempunyai bilangan atom yang sama di kedua-dua belah persamaan. Oleh itu, ia bermula dengan keseimbangan karbon, menambahkan dua sebagai pekali stoikiometrik yang mengiringi ia di sisi produk.
C2H6 + O2 → 2CO2 + H2O
Karbon telah seimbang di kedua-dua belah pihak, jadi kita teruskan untuk mengimbangi hidrogen dengan menambah tiga ke dalam molekul air.
C2H6 + O2 → 2CO2 + 3H2O
Akhirnya, kerana terdapat tujuh atom oksigen di sebelah kanan persamaan dan ia adalah elemen terakhir yang masih seimbang, nombor pecahan 7/2 diletakkan di hadapan molekul oksigen (walaupun keseluruhan pekali pada umumnya lebih disukai).
C2H6 + 7 / 2O2 → 2CO2 + 3H2O
Kemudian pastikan bahawa pada setiap sisi persamaan terdapat bilangan atom karbon yang sama (2), hidrogen (6) dan oksigen (7).
Contoh ketiga
Pengoksidaan besi oleh ion dikromat berlaku dalam medium asid (tidak seimbang dan dalam bentuk ioniknya).
Iman2+ + Cr2O72- → Iman3+ + Cr3+
Dengan menggunakan kaedah ion-elektron untuk mengimbangi, ia dibahagikan kepada dua reaksi separuh.
Pengoksidaan: Iman2+ → Iman3+
Pengurangan: Cr2O72- → Cr3+
Oleh kerana atom-atom besi sudah seimbang (1: 1), satu elektron ditambah di sisi produk untuk mengimbangi pertuduhan.
Iman2+ → Iman3+ + e-
Kini atom-atom Cr seimbang, menambah dua di sebelah kanan persamaan. Kemudian, apabila reaksi berlaku dalam medium asid, tujuh molekul H ditambah.2Atau di sisi produk untuk mengimbangi atom oksigen.
Cr2O72- → 2Cr3+ + 7H2O
Untuk mengimbangi atom H, empat belas ion H ditambah+ di sisi reaktan dan, selepas menyamakan bahan, caj tersebut diimbangi oleh tambahan enam elektron pada sisi yang sama.
Cr2O72- +14H+ + 6e- → 2Cr3+ + 7H2O
Akhirnya, kedua reaksi separuh ditambah, tetapi kerana hanya ada satu elektron dalam reaksi pengoksidaan, semua ini mesti didarabkan oleh enam.
6Fe2+ + Cr2O72- +14H+ + 6e- → Iman3+ + 2Cr3+ + 7H2O + 6e-
Akhirnya, elektron mesti dihapuskan di kedua-dua belah persamaan ionik global, mengesahkan bahawa caj dan bahan mereka betul seimbang.
Rujukan
- Chang, R. (2007). Kimia (Edisi ke-9). McGraw-Hill.
- Hein, M., dan Arena, S. (2010). Yayasan Kimia Kolej, Alternatif. Diperoleh dari books.google.com
- Tuli, G. D., dan Soni, P. L. (2016). Bahasa Kimia atau Persamaan Kimia. Diperoleh dari books.google.com
- Penerbitan Speedy (2015). Persamaan dan Jawapan Kimia (Panduan Kajian Speedy). Diperoleh dari books.google.com


