Struktur Kimia Natrium Bromida (NaBr), Hartanah dan Kegunaan
The natrium bromida adalah spesies kimia yang dimiliki oleh garam asal tidak organik. Strukturnya terdiri daripada halogen bromo dan unsur natrium logam dalam nisbah 1: 1. Rumus kimianya adalah NaBr dan berada dalam keadaan agregasi pepejal di bawah keadaan suhu dan tekanan standard (25 ° C dan 1 atm).
Biasanya ia boleh diperhatikan sebagai serbuk putih, dan ia dianggap sebagai sebatian jenis kristal yang juga memperlihatkan kelakuan hygroscopic; iaitu, ia mempunyai keupayaan untuk menyerap kelembapan dari persekitarannya.

Begitu juga, natrium bromida mempunyai ciri-ciri fizikal yang sangat mirip dengan sebatian ionik lain logam yang sama: natrium klorida. Klorida ini diwakili sebagai NaCl, yang lebih dikenali sebagai garam biasa atau garam meja.
Ia mempunyai banyak penggunaan dalam pelbagai bidang sains; sebagai contoh, ia digunakan dalam pengeluaran pelbagai jenis dadah (sedatif, hipnotik, anticonvulsants, antara lain), seperti dalam sintesis organik dan juga aplikasi foto.
Indeks
- 1 Struktur kimia
- 1.1 Kimia sintesis
- 2 Hartanah
- 3 Kegunaan
- 4 Rujukan
Struktur kimia
Seperti yang dinyatakan sebelum ini, natrium bromida berlaku dalam fasa pepejal dan, seperti banyak garam lain dari sifat bukan organik, mempunyai konformasi struktur kristal.
Ini molekul kristal yang terdiri daripada atom bromin dan satu atom hidrogen, mempunyai pengesahan padu jenis berpusat muka, seperti garam jenis logam yang sama haloid (Nai, NaCl dan NAF).
Susunan molekul ini membentuk asas struktur banyak sebatian, di mana pesanan dilakukan supaya setiap ion disimpan di tengah-tengah suatu angka octahedral, seperti yang ditunjukkan dalam gambar berikut.
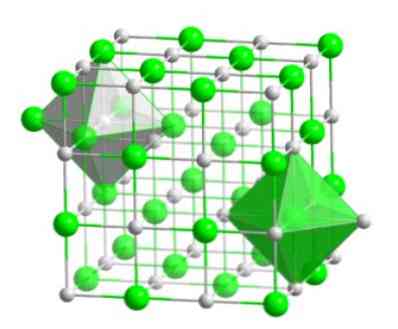
Dalam jenis kristal ini, anda dapat melihat bagaimana setiap ion mempunyai sekitar enam ion lain - yang mempunyai cas elektrik yang bertentangan - yang terletak di hujung angka octahedral.
Juga, struktur bahan ionik membayangkan yang mempunyai takat lebur yang tinggi kira-kira 747 ° C, komersial yang berada dalam dua bentuk: spesies anhydrous (tiada molekul air) dan spesies dihidrat (dengan dua molekul air dalam yang Formula struktur (NaBr · 2H2O)), yang mempunyai lebur yang berbeza.
Sintesis kimia
Natrium bromida berasal oleh tindak balas kimia yang berlaku di antara hidrogen bromida (HBr, fasa gas hidrogen halida) dan natrium hidroksida (NaOH, asas yang kukuh dalam fasa pepejal dan sifat-sifat hygroscopic).
Dengan cara ini ia dihasilkan secara komersial, dengan menambahkan lebihan bromin kepada larutan NaOH. Ini membentuk campuran bromida / bromida. Selanjutnya produk-produk yang dihasilkan tertakluk kepada penyejatan sehingga kering, dan dirawat dengan karbon untuk menghasilkan reaksi pengurangan ion bromat (BrO3-) kepada ion bromida (Br-).
Neutralisasi
Begitu juga, garam tak organik ini juga boleh dihasilkan melalui tindak balas peneutralan natrium karbonat (Na2CO3) dengan asid bromik (HBrO)3), mengikut prosedur yang sama yang dinyatakan di atas.
Melalui sintesis bahan ini dapat dihasilkan melalui reaksi antara besi dengan bromin dan air. Sebagai hasil tindak balas ini, spesies bromida ferrous ferrik berasal.
Seterusnya, spesies ini terbentuk (diwakili sebagai FeBr2/ FeBr3) dibubarkan dalam air dan sejumlah natrium karbonat ditambah. Akhirnya, penyelesaian itu ditapis dan diluluskan melalui proses penyejatan untuk akhirnya mendapatkan natrium bromida.
Hartanah
- Ia biasanya didapati dalam keadaan agregasi pepejal, dalam bentuk serbuk putih.
- Ia mempunyai struktur kristal, dengan susunan molekul berbentuk kubus berpusat pada muka.
- Titik lebur bahan ini adalah kira-kira 747 ° C untuk bentuk anhidratnya dan 36 ° C untuk bentuk dihydratednya, menunjukkan penguraian sebelum ia meleleh.
- Ia terdiri daripada ion natrium (Na+) dan ion bromida (Br-), dengan massa molar atau berat molekul 102.89 g / mol.
- Titik didihnya agak tinggi, diperhatikan pada 1390 ° C (bersamaan dengan 2530 ° F atau 1660 K).
- Keterlarutan spesies ini adalah sekitar 94.32 g / 100ml dalam air pada 25 ° C, meningkat dengan peningkatan suhu.
- Apabila tertakluk kepada pemanasan ke titik di mana ia terurai, bahan ini mengeluarkan gas bromin dan natrium oksida dianggap toksik.
- Ketumpatan bentuk natrium bromida anhidrat adalah 3.21 g / cm3, manakala sebatian dihidrat ialah 2.18 g / cm3.
- Keterlarutan dalam alkohol dianggap sederhana, seperti dalam pelarut lain seperti piridin, ammonia dan hydrazine.
- Ia mempunyai insolubiliti terhadap asetonitril dan aseton.
Kegunaan
- Dalam bidang perubatan digunakan sebagai ubat untuk beberapa keadaan yang menyebabkan sawan dan sebagai terapi untuk mencegah peti epilepsi pada pesakit dengan sindrom Wolf-Hirschhorn, serta sedatif dan rawatan hipnotik.
- Dalam perubatan veterinar digunakan pada anjing yang mempunyai gangguan penyitaan akibat kesan sampingan ubat seperti phenobarbital atau primidone.
- Dalam bidang industri minyak, ia digunakan dalam proses penyediaan cecair tertentu yang berbeza-beza ketumpatan yang digunakan dalam telaga minyak.
- Dalam bidang penyelidikan biologi, sifat mikrobiokidinya telah terbukti; iaitu, ia digunakan untuk mengawal pembangunan pelbagai jenis bakteria.
- Dalam sintesis tertentu jenis organik, garam sifat tidak organik digunakan untuk penyediaan spesies lain yang dibentuk oleh bromin. Sebagai contoh, melalui tindak balas Finkelstein beberapa alkil halida untuk mendapatkan kereaktifan yang lebih tinggi diperolehi, salah satu yang digunakan untuk digunakan dalam fotografi.
- Dalam bidang pembersihan dan pembasmian kuman, natrium bromida digunakan dalam kombinasi dengan klorin untuk kebersihan air besar, seperti kolam renang dan jakuzi..
Rujukan
- Wikipedia. (s.f.). Natrium bromida. Diambil dari en.wikipedia.org
- PubChem. (s.f.). Natrium bromida. Diambil dari pubchem.ncbi.nlm.nih.gov
- Johnson, A. W. (1999). Jemputan kepada Kimia Organik. Diperoleh dari books.google.com
- Sains Terus. (s.f.). Natrium bromida. Diperolehi daripada sciencedirect.com
- Riviere, J. E. dan Papich, M. G. (2009). Farmakologi Veterinar dan Terapeutik. Diperoleh dari books.google.com


