Jenis Ketones, Properties, Nomenclature, Uses and Examples
The keton mereka adalah sebatian organik yang mempunyai kumpulan karbonil (-CO). Mereka adalah sebatian mudah di mana karbon kumpulan karbonil itu terikat kepada dua atom karbon (dan rantai substituen mereka). Keton adalah "mudah" kerana mereka tidak mempunyai kumpulan reaktif seperti -OH atau -Cl yang melekat pada karbon.
Akhirnya, penghapusan keton dari tubuh manusia biasanya dikaitkan dengan tahap gula yang rendah (dalam kes diabetik dan / atau puasa yang melampau), yang boleh menyebabkan masalah kesihatan yang serius untuk pesakit.
Indeks
- 1 formula umum keton
- 2 jenis keton
- 2.1 Menurut struktur rantai anda
- 2.2 Menurut simetri radikalnya
- 2.3 Menurut tepu radikalnya
- 2.4 Dicetones
- 3 Ketoksikan fizikal dan kimia
- 3.1 Titik didih
- 3.2 Kelarutan
- 3.3 Keasidan
- 3.4 Reaktiviti
- 4 Nomenklatur
- 5 Perbezaan antara aldehid dan keton
- 6 Kegunaan industri dan kehidupan sehari-hari
- 7 Contoh keton
- 7.1 Butanon (C4H8O)
- 7.2 Cyclohexanone (C6H10O)
- 7.3 Testosteron (C19H22O2)
- 7.4 Progesteron (C21H30O2)
- 8 Rujukan
Formula umum keton
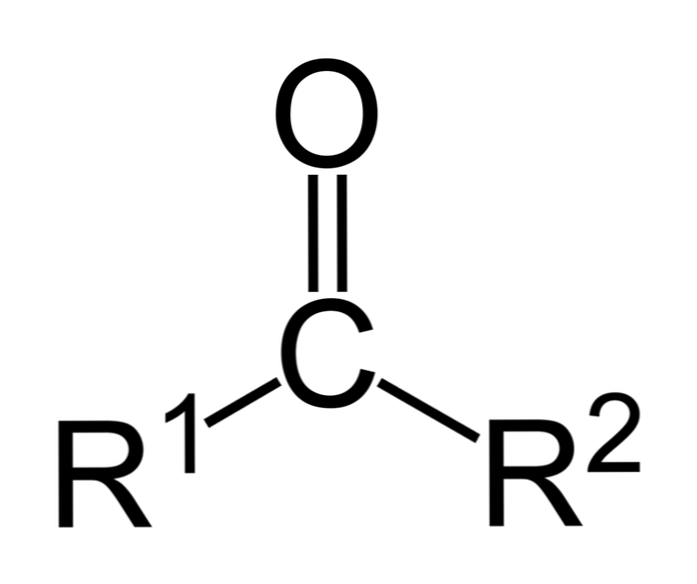
Keton adalah sebatian karbonil di mana kumpulan ini terikat kepada dua kumpulan hidrokarbon; ini mungkin kumpulan alkil, kumpulan cincin benzena atau kedua-duanya.
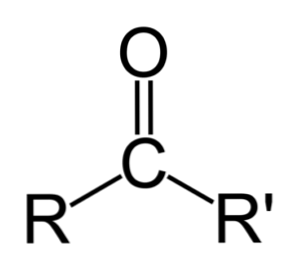
ketone A boleh diwakili hanya sebagai R- (C = O) -R ', di mana R dan R' adalah sama ada dua rantai hidrokarbon (alkana, alkena, alkina, sikloalkana, derivatif benzena dan lain-lain). Tiada keton dengan hidrogen melekat pada kumpulan karbonil.
Terdapat pelbagai kaedah untuk penyediaan keton dalam persekitaran industri dan makmal; Di samping itu, penting untuk diperhatikan bahawa keton boleh disintesis oleh organisma yang berlainan, termasuk manusia.
Dalam industri, kaedah yang paling biasa untuk sintesis keton melibatkan pengoksidaan hidrokarbon, biasanya dengan menggunakan udara. Pada skala kecil, keton biasanya disediakan melalui pengoksidaan alkohol sekunder, yang memberikan sebagai produk keton dan air.
Di luar kaedah yang paling biasa ini, keton dapat disintesis melalui alkenes, alkena, garam sebatian nitrogen, ester dan banyak sebatian lain, yang menjadikannya mudah diperoleh.
Jenis keton
Terdapat beberapa klasifikasi untuk keton, bergantung terutamanya kepada substituen dalam rantai mereka R. Berikut adalah klasifikasi yang paling biasa untuk bahan-bahan ini:
Mengikut struktur rantaian anda
Dalam kes ini, ketone yang diklasifikasikan dengan cara di mana ia berstruktur rantai: keton alifatik adalah mereka yang mempunyai dua R dan radikal R 'yang mempunyai alkil radikal membentuk (alkana, alkena, alkina dan sikloalkana).
Untuk bahagiannya, aromatik adalah yang membentuk derivatif benzena, sementara masih menjadi keton. Akhirnya, keton campuran adalah mereka yang mempunyai radikal alkil R dan radikal R 'aryl, atau sebaliknya.
Menurut simetri radikalnya
Dalam kes ini, substituen-substituen radikal R dan R dalam kumpulan karbonyl dipelajari; apabila ini adalah sama (sama) keton dipanggil simetri; tetapi apabila mereka berbeza (seperti kebanyakan keton), ini dipanggil asimetrik.
Menurut tepu radikalnya
Keton juga boleh dikelaskan mengikut tepu rantai karbon mereka; Jika ini adalah dalam bentuk alkana, keton dipanggil keton tepu. Sebaliknya, jika rantaian dijumpai sebagai alkena atau alkena, keton dipanggil keton tak tepu.
Dicetones
Ini adalah kelas keton yang berasingan, kerana rantai keton ini mempunyai dua kumpulan karbonil dalam strukturnya. Sesetengah keton ini mempunyai ciri-ciri unik, seperti panjang bon panjang antara karbon.
Sebagai contoh, diketones yang berasal dari sikloheksana dikenali sebagai quinones, yang hanya dua: orto-benzoquinone dan para-benzoquinone.
Sifat-sifat fizikal dan kimia keton
Keton, seperti kebanyakan aldehida, adalah molekul cecair dan mempunyai siri sifat fizikal dan kimia yang berbeza-beza bergantung pada panjang rantai mereka. Ciri-cirinya diterangkan di bawah:
Titik didih
Keton adalah sangat tidak menentu, dengan ketara kutub dan tidak boleh menderma hidrogen ikatan hidrogen (tidak mempunyai atom hidrogen dilampirkan kepada kumpulan karbonil), supaya mata semasa alkena yang lebih tinggi dan eter mendidih, tetapi lebih rendah daripada alkohol berat molekul yang sama.
Titik mendidih keton meningkat apabila saiz molekul meningkat. Ini disebabkan oleh campur tangan pasukan van der Waals dan daya dipole dipole, yang memerlukan jumlah tenaga yang lebih besar untuk memisahkan atom dan elektron yang tertarik kepada molekul..
Kelarutan
Keterlarutan keton mempunyai pengaruh yang kuat sebahagiannya terhadap keupayaan molekul ini untuk menerima hidrogen dalam atom oksigen mereka dan dengan itu membentuk ikatan hidrogen dengan air. Di samping itu, daya tarikan, daya hamparan dan dipol dipol diproses antara keton dan air, yang meningkatkan kesan larutnya.
Keton kehilangan keupayaan kelarutan semakin besar molekul mereka, kerana mereka mula memerlukan lebih banyak tenaga untuk larut dalam air. Mereka juga larut dalam sebatian organik.
Keasidan
Terima kasih kepada kumpulan karbonilnya, keton mempunyai sifat asid; ini berlaku kerana kapasiti penstabilan resonans kumpulan berfungsi ini, yang boleh memindahkan proton daripada ikatan berganda untuk membentuk asas conjugate yang dipanggil enol.
Reaktiviti
Keton adalah sebahagian daripada banyak reaksi organik; ini berlaku kerana kerapatan karbon karbonilnya kepada penambahan nukleofilik, sebagai tambahan kepada polariti ini.
Seperti yang dinyatakan di atas, kereaktifan tinggi keton menjadikan mereka produk perantaraan yang diiktiraf yang berfungsi sebagai asas untuk mensintesis sebatian lain.
Tatanama
Keton dinamakan mengikut keutamaan atau kepentingan kumpulan karbonil di seluruh molekul, jadi apabila molekul yang ditadbir oleh kumpulan karbonil, ketone itu dinamakan dengan menambah akhiran "-one" nama hidrokarbon.
Rantaian terpanjang dengan kumpulan karbonil diambil sebagai rantai utama, dan kemudian molekul dinamakan. Jika kumpulan karbonil tidak mempunyai keutamaan ke atas kumpulan fungsi molekul lain, maka ia dikenal pasti dengan "-oxo".
Untuk keton lebih rumit boleh mengenal pasti kedudukan kumpulan berfungsi dengan nombor, dan dalam hal diketones (keton dengan dua gantian R dan 'sama R), molekul dinamakan dengan akhiran "-dione".
Akhirnya, perkataan "ketone" juga boleh digunakan selepas mengenal pasti rantai radikal yang dilampirkan pada kumpulan fungsional karbonil.
Perbezaan antara aldehid dan keton
Perbezaan terbesar antara aldehid dan keton ialah kehadiran atom hidrogen yang melekat pada kumpulan karbonil dalam aldehida.
atom ini mempunyai kesan penting apabila molekul yang terlibat dalam tindak balas pengoksidaan: aldehid yang membentuk asid karboksilik atau garam asid karboksilik, bergantung kepada sama ada pengoksidaan berlaku di bawah keadaan berasid atau asas.
Sebaliknya, keton tidak mempunyai hidrogen ini, jadi langkah minimum yang diperlukan untuk pengoksidaan tidak berlaku.
Terdapat kaedah untuk mengoksidakan keton (dengan agen pengoksidaan lebih kuat daripada yang biasa digunakan), tetapi ini memecahkan molekul keton, memisahkannya terlebih dahulu menjadi dua atau lebih bahagian.
Kegunaan perindustrian dan kehidupan sehari-hari
Dalam industri keton sering diperhatikan dalam minyak wangi dan cat, mengambil peranan penstabil dan bahan pengawet yang menghalang komponen lain campuran dari merendahkan; mereka juga mempunyai spektrum luas sebagai pelarut dalam industri-industri yang mengeluarkan bahan peledak, cat dan tekstil, sebagai tambahan kepada farmaseutikal.
Aseton (keton terkecil dan paling mudah) adalah pelarut yang diiktiraf di seluruh dunia, dan digunakan sebagai penghilang cat dan nipis.
Secara semula jadi, keton boleh muncul sebagai gula, dipanggil ketoses. Ketosis adalah monosakarida yang mengandungi satu keton per molekul. Ketose yang paling terkenal adalah fruktosa, gula yang terdapat dalam buah-buahan dan madu.
Biosintesis asid lemak yang berlaku di dalam sitoplasma sel haiwan juga berlaku melalui tindakan keton. Akhirnya, dan seperti yang dinyatakan di atas, mungkin terdapat keton keton dalam darah selepas berpuasa atau dalam kes diabetes.
Contoh keton
Butanon (C4H8O)
Juga dikenali sebagai MEK (atau MEC), cecair ini dihasilkan secara besar-besaran dalam industri dan digunakan sebagai pelarut.
Cyclohexanone (C6H10O)
Diproduksi secara besar-besaran, keton ini digunakan sebagai pendahulu kepada bahan nilon sintetik.
Testosteron (C19H22O2)
Ia adalah hormon utama seks lelaki dan steroid anabolik, yang terdapat dalam kebanyakan vertebrata.
Progesterone (C21H30O2)
Steroid endogen dan hormon seks yang terlibat dalam kitaran haid, kehamilan dan embriogenesis pada manusia dan spesies lain.
Rujukan
- Wikipedia. (s.f.). Ketone Diambil dari en.wikipedia.org
- Britannica, E. (s.f.). Ketone Diperolehi daripada britannica.com
- Universiti, M. S. (s.f.). Aldehid dan Ketones. Diperolehi daripada chemistry.msu.edu
- ChemGuide. (s.f.). Memperkenalkan Aldehid dan Keton. Diperolehi daripada chemguide.co.uk
- Calgary, U. O. (s.f.). Ketones. Diperolehi daripada chem.ucalgary.ca


