Asid hidrobromik (HBr), sifat, pembentukan, penggunaan
The Asid hidrobromik adalah sebatian organik yang dihasilkan daripada larutan akueus gas yang dipanggil hydrogen bromide. Formula kimianya adalah HBr, dan boleh dipertimbangkan dengan cara yang berbeza setara: sebagai hidrida molekul, atau hidrogen halida dalam air; iaitu hydrazide.
Dalam persamaan kimia, ia harus ditulis sebagai HBr (ac), untuk menunjukkan bahawa ia adalah asid hidrobromik dan bukan gas. Asid ini adalah salah satu daripada asid hidroklorik yang paling kuat dan diketahui, HCl. Penjelasan untuk ini terletak pada sifat ikatan kovalennya.
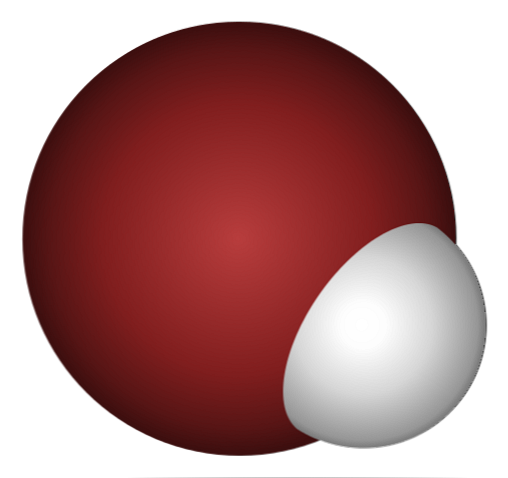
Kenapa HBr seperti asid, dan lebih banyak dibubarkan di dalam air? Kerana ikatan kovalen H-Br sangat lemah, kerana tumpang tindih yang kurang dari 1s orbital H dan 4p dari Br.
Ini tidak menghairankan jika anda melihat dengan teliti pada imej di atas, di mana dengan jelas atom bromin (coklat) jauh lebih besar daripada atom hidrogen (putih).
Akibatnya, sebarang gangguan menyebabkan pecahan ikatan H-Br, melepaskan H ion+. Kemudian, asid hidrobromik adalah asid Brönsted, kerana ia memindahkan proton atau ion hidrogen. Kekuatannya sedemikian rupa sehingga digunakan dalam sintesis beberapa senyawa organobrominasi (seperti 1-Bromo etana, CH3CH2Br).
Asid hidrobromik adalah, selepas hidrik, HI, salah satu hidrokida yang paling kuat dan paling berguna untuk penghadaman sampel pepejal tertentu.
Indeks
- 1 Struktur asid hidrobromik
- 1.1 Keasidan
- 2 Sifat fizikal dan kimia
- 2.1 Formula molekul
- 2.2 Berat molekul
- 2.3 Penampilan fizikal
- 2.4 Bau
- 2.5 Ambang Bau
- 2.6 Ketumpatan
- 2.7 Takat lebur
- 2.8 Titik didih
- 2.9 Kelarutan dalam air
- 2.10 Ketumpatan wap
- 2.11 pKa keasidan
- 2.12 Kapasiti kalori
- 2.13 Standard entalpi molar
- 2.14 Entropi molar standard
- 2.15 Titik kilat
- 3 Nomenklatur
- 4 Bagaimana ia terbentuk??
- 4.1 Campuran hidrogen dan bromin dalam air
- 4.2 Kesuburan fosforus
- 4.3 Sulfur dioksida dan bromin
- 5 Kegunaan
- 5.1 Penyediaan bromida
- 5.2 Sintesis alkil halida
- 5.3 Pemangkin
- 6 Rujukan
Struktur asid hydrobromic
Struktur H-Br ditunjukkan dalam imej, sifat dan ciri-cirinya, walaupun gas, berkait rapat dengan penyelesaian berairnya. Itulah sebabnya terdapat satu titik di mana anda mendapat kekeliruan mengenai mana dari kedua-dua sebatian ini yang disifatkan sebagai: HBr atau HBr (ac).
Struktur HBr (ac) adalah berbeza daripada HBr, kerana sekarang molekul air melarutkan molekul diatomik ini. Apabila cukup dekat, H dipindahkan+ kepada molekul H2Atau seperti yang ditunjukkan dalam persamaan kimia berikut:
HBr + H2O => Br-- + H3O+
Oleh itu, struktur asid hidrobromik terdiri daripada ion Br-- dan H3O+ berinteraksi dengan elektrostatik. Kini, ia berbeza sedikit daripada ikatan kovalen H-Br.
Keasaman yang besar adalah disebabkan anion besar Br- tidak dapat berinteraksi dengan H3O+, tidak dapat menghalangnya daripada memindahkan H+ kepada spesies kimia yang lain.
Keasidan
Sebagai contoh, Cl- dan F- walaupun mereka tidak membentuk ikatan kovalen dengan H3O+, mereka boleh berinteraksi melalui kuasa-kuasa intermolecular yang lain, seperti jambatan hidrogen (yang hanya F- boleh terima mereka). Jambatan hidrogen F--H-OH2+ "Mengganggu" sumbangan H+.
Oleh sebab itu, asid hidrofluorik, HF, adalah asid yang lebih lemah dalam air daripada asid hidrobromik; Kerana, interaksi ionik Br- H3O+ jangan ganggu pemindahan H+.
Walau bagaimanapun, walaupun air terdapat dalam HBr (ac), tingkah laku pada akhir akaun adalah serupa dengan molekul H-Br; iaitu, H+ Ia dipindahkan dari HBr atau Br-H3O+.
Sifat fizikal dan kimia
Formula molekul
HBr.
Berat molekul
80,972 g / mol. Perhatikan bahawa, seperti yang dinyatakan dalam seksyen sebelumnya, hanya HBr yang dipertimbangkan dan bukan molekul air. Sekiranya berat molekul diambil dari formula Br-H3O+ ia akan mempunyai nilai kira-kira 99 g / mol.
Penampilan fizikal
Cecair kuning tidak berwarna atau pucat, yang akan bergantung kepada kepekatan HBr yang dibubarkan. Semakin kuning, ia lebih pekat dan berbahaya.
Bau
Acrid, menjengkelkan.
Ambang ambang
6.67 mg / m3.
Ketumpatan
1.49 g / cm3 (larutan akueus pada 48% w / w). Nilai ini, seperti yang sepadan dengan takat lebur dan didih, bergantung kepada jumlah HBr yang dibubarkan di dalam air.
Titik lebur
-11ºC (12ºF, 393ºK) (penyelesaian berair pada 49% w / w).
Titik didih
122 ° C (252 ° F. 393 ° K) pada 700 mmHg (larutan berair 47-49% w / w).
Kelarutan dalam air
-221 g / 100 ml (pada 0ºC).
-204 g / 100 ml (15 ºC).
-130 g / 100 ml (100 ºC).
Nilai ini merujuk kepada HBr gas, bukan kepada asid hidrobromik. Seperti yang dapat dilihat, peningkatan suhu menurun kelarutan HBr; tingkah laku yang semula jadi dalam gas. Oleh itu, jika penyelesaian HBr (ac) tertumpu diperlukan, lebih baik untuk bekerja dengan mereka pada suhu rendah.
Jika bekerja pada suhu tinggi, HBr akan melarikan diri dalam bentuk molekul diatom gas, jadi reaktor mesti dimeteraikan untuk mengelakkan kebocoran.
Ketumpatan wap
2.71 (berhubung dengan udara = 1).
Asid pKa
-9.0. Ini berterusan sangat negatif menunjukkan kekuatan keasidannya.
Kapasiti kalori
29.1 kJ / mol.
Entalpi molar standard
198.7 kJ / mol (298 ºK).
Entropi molar standard
-36.3 kJ / mol.
Titik pencucuhan
Tidak mudah terbakar.
Tatanama
Asid hidrobromik namanya menggabungkan dua fakta: kehadiran air, dan bromin mempunyai satu valensi -1 di dalam sebatian. Dalam bahasa Inggeris, ia lebih jelas: asid hidrobromik, di mana awalan 'hidro' (atau hidro) merujuk kepada air; walaupun, sebenarnya, ia juga boleh merujuk kepada hidrogen.
Bromin mempunyai valence -1 kerana ia terikat kepada atom hidrogen yang kurang elektronegatif daripada itu; tetapi jika ia dikaitkan atau berinteraksi dengan atom oksigen, ia boleh mempunyai banyak valensi, seperti: +2, +3, +5 dan +7. Dengan H hanya boleh mengadopsi satu valensi, dan itulah sebabnya sufiks -ico ditambah namanya.
Walaupun HBr (g), hidrogen bromida, tidak anhidrat; iaitu, ia tidak mempunyai air. Oleh itu, ia dinamakan di bawah standard tatanama yang lain, sepadan dengan hidrogen halida.
Bagaimana ia terbentuk??
Terdapat beberapa kaedah sintetik untuk menyediakan asid hydrobromic. Sebahagian daripada mereka adalah:
Campuran hidrogen dan bromin dalam air
Tanpa menerangkan butiran teknikal, asid ini boleh didapati dari campuran langsung hidrogen dan bromin dalam reaktor yang dipenuhi dengan air.
H2 + Br2 => HBr
Dengan cara ini, sebagai bentuk HBr, ia larut dalam air; Ini boleh menyeretnya dalam penyulingan, jadi penyelesaian boleh diekstrak dengan kepekatan yang berbeza. Hidrogen adalah gas, dan bromin cecair kemerahan gelap.
Tribromide fosforus
Dalam proses yang lebih terperinci, pasir, fosforus terhidrasi merah dan bromin bercampur. Perangkap air ditempatkan dalam mandian ais untuk menghalang HBr daripada melarikan diri dan membentuk, sebaliknya, asid hidrobromik. Reaksi adalah:
2P + 3Br2 => 2PBr3
PBr3 + 3H2O => 3HBr + H3PO3
Sulfur dioksida dan bromin
Cara lain untuk mempersiapkannya adalah dengan bertindak balas terhadap bromin dengan sulfur dioksida di dalam air:
Br2 + SO2 + 2H2O => 2HBr + H2SO4
Ini adalah reaksi redoks. The Br2 ia mengurangkan, ia memperoleh elektron, dengan menghubungkan dengan hidrogen; manakala SO2 ia mengoksidasi, ia kehilangan elektron, apabila ia membentuk ikatan yang lebih kovalen dengan oxygens lain, seperti dalam asid sulfurik.
Kegunaan
Penyediaan bromida
Garam bromida boleh disediakan jika HBr (ac) direaksikan dengan hidroksida logam. Sebagai contoh, pengeluaran kalsium bromida dianggap sebagai:
Ca (OH)2 + 2HBr => CaBr2 + H2O
Contoh lain adalah untuk natrium bromida:
NaOH + HBr => NaBr + H2O
Oleh itu, banyak bromida tak organik boleh disediakan.
Sintesis alkil halida
Dan bagaimana dengan bromida organik? Ini adalah sebatian organobromin: RBr atau ArBr.
Dehidrasi alkohol
Bahan mentah untuk mendapatkannya boleh menjadi alkohol. Apabila protonated oleh keasidan HBr, mereka membentuk air, yang merupakan kumpulan keluar yang baik, dan sebaliknya atom volum Br digabungkan, yang akan menjadi kovalen dikaitkan dengan karbon:
ROH + HBr => RBr + H2O
Dehidrasi ini dilakukan pada suhu di atas 100 ° C, untuk memudahkan pecahnya ikatan R-OH2+.
Tambahan kepada alkena dan alkena
Molekul HBr boleh ditambah daripada larutan berair kepada ikatan rangkap dua atau tiga alkena atau alkyne:
R2C = CR2 + HBr => RHC-CRBr
RC≡CR + HBr => RHC = CRBr
Beberapa produk boleh didapati, tetapi di bawah keadaan mudah, produk pertama kali dibentuk di mana bromin dikaitkan dengan karbon sekunder, tertiari atau kuaternary (peraturan Markovnikov).
Halida ini campur tangan dalam sintesis sebatian organik lain, dan pelbagai kegunaannya sangat luas. Juga, sesetengah daripada mereka juga boleh digunakan dalam sintesis atau reka bentuk ubat baru.
Puncak Ethereal
Daripada eter, dua alkil halida boleh diperoleh secara serentak, masing-masing membawa satu daripada dua rantai sisi R atau R 'dari eter awal R-O-R'. Ia berlaku sesuatu yang serupa dengan dehidrasi alkohol, tetapi mekanisme reaksinya berbeza.
Reaksi boleh dijelaskan dengan persamaan kimia berikut:
ROR '+ 2HBr => RBr + R'Br
Dan air juga dibebaskan.
Pemangkin
Keasamannya sedemikian rupa sehingga dapat digunakan sebagai pemangkin asid yang berkesan. Daripada menambah anion Br- ke struktur molekul, membuka jalan untuk molekul lain untuk melakukannya.
Rujukan
- Graham Solomons T.W, Craig B. Fryhle. (2011). Kimia Organik. Amines (10th edisi.). Wiley Plus.
- Carey F. (2008). Kimia Organik (Edisi keenam). Mc Graw Hill.
- Steven A. Hardinger. (2017). Glosari Kimia Organik: Asid hidrobromik. Diperolehi daripada: chem.ucla.edu
- Wikipedia. (2018). Asid hidrobromik. Diperolehi daripada: en.wikipedia.org
- PubChem. (2018). Asid hidrobromik. Diperolehi daripada: pubchem.ncbi.nlm.nih.gov
- Institut Kebangsaan untuk Keselamatan dan Kebersihan di Tempat Kerja. (2011). Hidrogen bromida [PDF] Diperolehi daripada: insht.es
- PrepChem. (2016). Penyediaan asid hydrobromic. Diperolehi daripada: prepchem.com


