Struktur kimia, sifat, kegunaan Aluminium Chloride (AlCl3)
The aluminium klorida atau aluminium trichloride (AlCl3) adalah garam binari yang dibentuk oleh aluminium dan klorin. Kadang-kadang ia muncul sebagai serbuk kuning kerana ia memberikan kekotoran disebabkan kehadiran besi (III) klorida.
Ia diperoleh dengan menggabungkan unsur-unsurnya. Aluminium, yang mempunyai tiga elektron dalam tahap tenaga terakhir (keluarga IIIA), cenderung untuk menghasilkannya kerana sifat logamnya. Klorin dengan tujuh elektron dalam tahap tenaga terakhir (keluarga VIIA) cenderung untuk mendapatkannya untuk menyelesaikan oktetnya.
Adalah dianggap bahawa ikatan terbentuk antara aluminium dan klorin dalam trichloride aluminium adalah kovalen, walaupun ia adalah kesatuan antara logam dan bukan logam.
Terdapat dua jenis klorida aluminium:
- Aluminium klorida tanpa oksida. AlCl3.
- Aluminium klorida hexahydrate. AlCl3. 6H2O. Kompaun ini boleh didapati dalam bentuk pepejal atau penyelesaian.
Indeks
- 1 Struktur kimia
- 2 Hartanah
- 2.1 Fizikal
- 2.2 Kimia
- 3 Kegunaan
- 4 Risiko: kesan yang mungkin
- 5 Cadangan
- 6 Rujukan
Struktur kimia
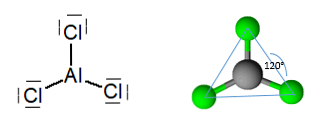
Anhydrous trichloride aluminium, adalah molekul dengan geometri trigonal planar, dengan sudut 120 ° bersamaan dengan spigen hibrid atom2.
Walau bagaimanapun, molekul ini dianjurkan dalam bentuk dimer, di mana atom klorin menyumbangkan sepasang elektron untuk membentuk bon. Ini dikenali sebagai bon kovalen yang diselaraskan.
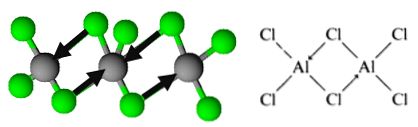
Ini adalah bagaimana pengurangan dimer aluminium trichloride.
Organisasi ini membolehkan kompleks untuk membentuk rangkaian lapisan dimeric. Apabila air dituangkan pada trichloride aluminium pepejal, mereka tidak memisahkan seperti yang diharapkan dari sebatian ionik, tetapi mengalami hidrolisis yang kuat.
Sebaliknya, dalam larutan berair dicairkan adalah ion terkoordinasi [Al (H2O)6]+3 dan klorida. Struktur ini sangat mirip dengan yang diborane.
Dengan cara ini anda mempunyai formula Al2Cl6
Sekiranya perbezaan dalam elektronegativiti atom yang membentuk ikatan dalam sebatian ini diukur, berikut boleh diperhatikan:
Bagi aluminium Al nilai elektronegativiti ialah 1.61 C dan klorin ialah 3.16 C. Perbezaan dalam elektronegativiti ialah 1.55 C.
Mengikut peraturan teori mengikat, untuk sebatian menjadi ionik ia mesti mempunyai perbezaan dalam elektronegativiti atom yang membentuk ikatan nilai lebih besar atau sama dengan 1.7 C.
Dalam kes Al-Cl bond, perbezaan dalam elektronegativity adalah 1.55 C, yang memberikan aluminium trichloride suatu ikatan ikatan kovalen. Nilai kecil ini boleh dikaitkan dengan ikatan kovalen yang diselaraskan oleh molekul.
Hartanah
Fizikal
Rupa: pepejal putih, kadang-kadang kuning kerana kekotoran yang disebabkan oleh ferric chloride
Ketumpatan: 2.48 g / mL
Jisim molar: 133.34 g / mol
Penyejukan: sublimat pada 178 ° C, jadi titik lebur dan didihnya sangat rendah.
Memandu: kurang menjalankan elektrik.
Kelarutan: ia tidak larut dalam air kerana ia adalah asid Lewis. Ia larut dalam pelarut organik seperti benzena, karbon tetraklorida dan kloroform.
Bahan kimia
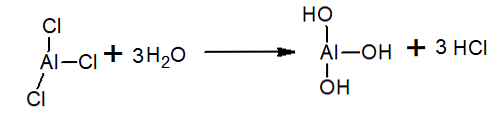
Di dalam air, trichloride aluminium dihidrolisiskan membentuk HCl dan ion hidronium dan aluminium hidroksida:
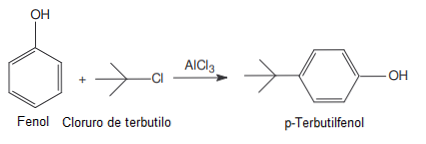
Ia digunakan dalam tindak balas Friedel-Crafts sebagai pemangkin (bahan yang boleh dipulihkan pada akhir reaksi, kerana ia hanya untuk mempercepatkan, perlahan atau memulakan reaksi).
Ia adalah bahan menghakis.
Dalam penguraian apabila ia bertindakbalas dengan hebat dengan air ia menghasilkan oksida aluminium dan gas berbahaya seperti hidrogen klorida.
Kegunaan
- Antiperspirant.
- Pemangkin dalam penyerapan dan alkilasi Friedel-Crafts.
Risiko: kesan yang mungkin
- Ia adalah bahan menghakis, menyebabkan luka bakar pada kulit dan kerosakan mata yang serius.
- Reacts violently with water.
- Ia berbahaya bagi alam sekitar.
- Sangat toksik kepada organisma akuatik.
Cadangan
Elakkan pendedahan kepada produk tanpa langkah keselamatan yang diperlukan. Mesti gunakan, cermin mata keselamatan, sarung tangan, pakaian yang sesuai, kasut yang dilindungi.
Sekiranya sedutan. Penyedutan debu dapat merengsakan saluran pernafasan akibat sifat menghakis bahan tersebut. Gejala termasuk sakit tekak, batuk dan sesak nafas. Gejala-gejala edema pulmonari mungkin kes terlambat dan teruk boleh membawa maut. Gerakkan mangsa ke tempat yang lapang tanpa bahan pencemar. menyediakan respirasi tiruan jika perlu. Sekiranya anda mengalami kesukaran bernafas, berikan oksigen. Hubungi doktor.
Sekiranya terdapat sentuhan kulit. AlCl3 Ia menghakis. Ia boleh menyebabkan kerengsaan atau terbakar dengan kemerahan dan kesakitan. Basuh segera selepas bersentuhan dengan banyak air selama sekurang-kurangnya 20 minit. Jangan meneutralkan atau menambah bahan selain daripada air. Tanggalkan pakaian yang tercemar dan basuh sebelum digunakan semula. segera berjumpa doktor sekiranya berlaku kecederaan.
Apabila bersentuhan dengan mata. AlCl3 Ia menghakis. Ia menyebabkan rasa sakit yang sengit, penglihatan kabur, dan kerosakan tisu. Segera bilas mata dengan air selama sekurang-kurangnya 20 minit, dan pastikan kelopak mata terbuka untuk memastikan seluruh mata dan tisu kelopak mata dibersihkan. Pemancaran mata dalam beberapa saat adalah penting untuk mencapai keberkesanan maksimum. Sekiranya anda mempunyai kanta sentuh, tanggalkannya selepas 5 minit pertama dan kemudian teruskan bilas mata anda. Rujuk doktor. Ia boleh menyebabkan kerosakan yang serius kepada kornea, konjunktiva atau bahagian mata yang lain.
Sekiranya pengambilan. AlCl3 Ia menghakis. Pembakaran boleh menyebabkan rasa sakit di dalam mulut dan esofagus dan membakar membran mukus. Ia boleh menghasilkan ketidakselesaan gastrointestinal dengan sakit perut, mual, muntah dan cirit-birit. TIDAK MEMBUAT MEREKA. Bilas mulut, dan berikan air untuk diminum. Jangan berikan apa-apa secara lisan kepada orang yang tidak sedarkan diri. Hubungi doktor. Sekiranya muntah berlaku secara spontan, letakkan mangsa di sebelahnya untuk mengurangkan risiko aspirasi.
Orang yang mengalami gangguan kulit atau masalah mata yang sedia ada atau fungsi pernafasan terjejas mungkin lebih mudah terdedah kepada kesan bahan
Pembungkusan dan penyimpanan sebatian AlCl3 mesti dilakukan di tempat yang berventilasi, bersih dan kering.
Rujukan
- Buku kimia, (2017), Aluminium klorida. Dipulihkan dari chemicalbook.com
- kosmos dalam talian, cosmos.com.mx
- Sharpe, A.G., (1993), Kimia Organik, Sepanyol, Editorial Reverté, S.A..
- F., (2017), AlCl Aluminium Chloride3, The Insignia. Diambil daripadablog.elinsignia.com.
- TriHealth, (2018), Aluminium Trichloride, kemas kini terakhir, 4 Mac, 2018, Diperolehi daripada trihealth.adam.com.
- RxWiki, (s.f), Aluminium Chloride, Diperolehi daripada, rxwiki.com.


