Sodium Dichromate Properties, Pengeluaran, Bahaya dan Kegunaan
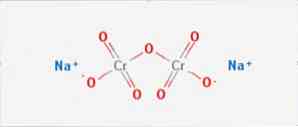
The natrium dikromat adalah sebatian organik formula Na2Cr2O7. Ia adalah salah satu daripada banyak sebatian kromium heksavalen (Cr VI). Strukturnya digambarkan dalam gambar 1, walaupun biasanya garam ditangani dalam bentuk dihydrated yang formulanya akan Na2Cr2O7 · H2O.
Ia mempunyai dua ikatan ionik antara molekul natrium dan oksigen yang dikenakan secara negatif. Biji kromium diekstrak dari natrium dikromat. Jutaan kilogram natrium dikromat dikeluarkan setiap tahun.
China adalah pengeluar terbesar natrium dikromat, namun tumbuhan kimia China mempunyai pengeluaran yang agak rendah, kurang daripada 50,000 tan setiap tahun, berbanding kilang Kazakhstan yang menghasilkan lebih daripada 100,000 tan setahun.
Tumbuhan di Rusia, Amerika Syarikat dan United Kingdom mempunyai pengeluaran perantaraan antara 50,000 hingga 100,000 tan setahun (Kogel, 2006).
Dari segi kereaktifan dan penampilan, natrium dikromat mempunyai sifat yang serupa dengan kalium dikromat, bagaimanapun, garam natrium lebih larut dalam air dan mempunyai berat bersamaan kurang daripada garam kalium.
Natrium dikromat menghasilkan wap kromium toksik apabila dipanaskan. Ia adalah agen pengoksidaan yang kuat dan sangat menghakis.
Kompaun ini boleh didapati dalam sumber air minuman yang tercemar oleh proses perindustrian yang berlainan seperti teknik galvanizing atau elektroplating, penyamakan kulit dan pembuatan tekstil.
Indeks
- 1 Sifat fizikal dan kimia
- 2 Kaedah pengeluaran
- 3 Reaktiviti dan bahaya
- 4 Penggunaan dan aplikasi
- 5 Biokimia
- 6 Rujukan
Sifat fizikal dan kimia
Natrium dikromat terdiri daripada kristal dengan struktur monoklinik oren merah dalam bentuk anhidrat dan tidak berbau mereka. Berat molekulnya ialah 261.97 g / mol dalam bentuk anhydrous dan 298.00 g / mol dalam bentuk dihydrate.
Ia mempunyai titik lebur 356.7 darjah Celsius, titik didih 400 darjah Celcius di mana ia terurai. Ia mempunyai ketumpatan 2.52 g / ml.

Rajah 2 menunjukkan penampilan natrium dikromat. kelarutan dalam air adalah 187 g per 100 gram pada 25 darjah Celsius dan kelarutan dalam etanol adalah 513,2 gram seliter kepada 19.4 darjah Celsius (Pusat Kebangsaan bagi Maklumat Bioteknologi, S. F.).
Ia dianggap sebagai sebatian yang stabil jika disimpan di bawah keadaan yang disyorkan dan tidak mudah terbakar. Oleh kerana ia adalah agen pengoksidaan yang kuat, ia menghakis, dan dalam larutan ia mempunyai keupayaan untuk menurunkan pH kepada 4 dalam larutan 1% w / v.
Kaedah pengeluaran
Natrium kromat boleh ditukar kepada dikromromat dengan proses berterusan yang merawat dengan asid sulfurik, karbon dioksida atau kombinasi kedua-dua.
Penyejatan minuman keras natrium dikromat menyebabkan pemendapan natrium sulfat dan / atau natrium bikarbonat, dan sebatian ini dikeluarkan sebelum penghabluran terakhir natrium dikromat..
Natrium dikromat boleh dilakukan dalam proses tiga langkah:
- Hidangan alkali untuk pengoksidaan kromit
- Leaching. Pengekstrakan bahan larut dari campuran oleh tindakan pelarut cecair
- Penukaran natrium monokromat dalam natrium dikromat dengan cara asid.
Anhydrous natrium dikromat boleh disediakan oleh lebur natrium dikromat dihidrat, crystallizing penyelesaian akueus dikromat di atas 86 darjah C, atau penyelesaian pengeringan natrium dikromat dalam pengering semburan.
Penyelesaian natrium dikromat pada 69 dan 70% w / v digunakan sebagai kaedah yang mudah dan kos efektif untuk menghantar kuantiti, mengelakkan keperluan pengendalian manual atau pembubaran kristal.
Reaktiviti dan bahaya
Ia adalah agen pengoksidaan yang kuat. Tidak serasi dengan asid kuat. Kenalan dengan bahan mudah terbakar boleh menyebabkan kebakaran. Wap toksik oksida kromium boleh dibentuk dengan kehadiran haba atau api.
"Campuran asid kromik" asid dikromat dan asid sulfurik dengan residu organik menimbulkan reaksi eksotermik yang ganas. Campuran ini digabungkan dengan residu aseton juga membawa kepada tindak balas ganas.
Gabungan asid dikromat dan asid sulfurik dengan alkohol, etanol dan 2-propanol, menimbulkan reaksi eksotermik yang ganas. Oleh kerana berlakunya banyak insiden yang melibatkan pencampuran asid dikromat-sulfurik dengan bahan organik yang boleh teroksida, mungkin lebih baik untuk mengelakkan interaksi tersebut.
Gabungan dikromat dengan hydrazine adalah bahan letupan, tindak balas dikromat boleh dijangka kuat dengan amina secara amnya. Penambahan garam dikromat dehidrasi kepada anhidrida asetik membawa kepada tindak balas eksotermik yang akhirnya meletup.
Boron, silikon dan dikromat membentuk campuran piroteknik. Campuran asid asetik, 2-methyl-2-pentenal dan dikromat menyebabkan tindak balas berleluasa (Datasheet Kimia Natrium Dichromate, 2016).
Penyedutan debu atau kabus menyebabkan kerengsaan pernafasan yang kadang-kadang menyerupai asma. Penebalan sepal mungkin berlaku. Ia dianggap racun.
Pengingesan menyebabkan muntah-muntah, cirit-birit, dan, sangat luar biasa, komplikasi perut dan buah pinggang. Sentuhan dengan mata atau kulit menyebabkan kerengsaan tempatan. Pendedahan berulang kepada kulit menyebabkan dermatitis.
Natrium dikromat adalah karsinogen pada manusia. Terdapat bukti bahawa sebatian kromium heksavalen atau Cr (VI) boleh menyebabkan kanser paru-paru pada manusia. Telah ditunjukkan bahawa natrium dikromat menyebabkan kanser paru-paru pada haiwan.
Manakala natrium dikromat belum dikenal pasti sebagai sebatian teratogen atau risiko pembiakan, ia dikenali bahawa sebatian kromium heksavalen Cr (VI) adalah teratogen dan menyebabkan kerosakan pembiakan dan mengurangkan kesuburan dan mengganggu kitaran haid.
Natrium dikromat boleh menyebabkan kerosakan hati dan buah pinggang supaya ia dikendalikan dengan penjagaan yang melampau (Jabatan Kesihatan New Jersey, 2009).
Sekiranya pengambilan, mangsa harus minum air atau susu; tidak pernah menyebabkan muntah. Sekiranya bersentuhan dengan kulit atau mata, ia harus dirawat sebagai terbakar asid; Bilas mata anda dengan air selama sekurang-kurangnya 15 minit.
Luka luar boleh disapu dengan larutan 2% natrium thiosulfat. Dalam semua kes, seorang doktor perlu dirujuk.
Kegunaan dan aplikasi
Selain daripada kepentingannya dalam pembuatan bahan kimia kromium lain, natrium dikromat juga mempunyai banyak kegunaan langsung sebagai ramuan dalam pengeluaran:
- Kemasan logam: membantu rintangan kakisan dan membersihkan permukaan logam, juga memihak kepada pelekatan cat.
- Produk organik: digunakan sebagai agen pengoksidaan dalam pembuatan produk seperti vitamin K dan lilin.
- Pigmen: digunakan dalam pembuatan pigmen kromat anorganik di mana ia menghasilkan pelbagai warna yang stabil kepada cahaya. Sesetengah gred kromat juga digunakan sebagai perencat kakisan pada lapisan bawah dan primer.
- Seramik: digunakan dalam penyediaan gelas berwarna dan glazes seramik.
- Tekstil: digunakan sebagai mordan untuk pewarna berasid untuk memperbaiki sifat pewarna cepat.
- Pengeluaran kromium sulfat.
(Natrium dikromat, Blok bangunan untuk hampir semua sebatian kromium lain, 2010-2012)
Sodium dikromat Dihydrate, penggunaannya sesuai dalam pelbagai keadaan termasuk aplikasi suhu tinggi, seperti glazes seramik dan kaca berwarna.
Kromium oksida, yang lebih keras daripada oksida logam lain, seperti titanium atau besi, sesuai untuk persekitaran di mana suhu dan keadaan prosesnya adalah agresif.
Bahan ini digunakan terutamanya untuk menghasilkan sebatian kromium lain, tetapi ia juga digunakan dalam lumpur bentonite yang digunakan dalam pengeluaran minyak, dalam pengawet kayu, dalam pengeluaran bahan kimia organik dan sebagai perencat kakisan..
Apabila dicampur dengan aluminium dan kalium dikromat, menggunakan proses alumino-termal, oksida kromik menghasilkan kemurnian logam kromium yang tinggi. Ini adalah ramuan penting dalam pengeluaran superalloy prestasi tinggi yang digunakan dalam industri aeroangkasa.
Dalam sintesis organik, natrium dikromat digunakan sebagai agen pengoksidaan dalam pengurangan tindak balas oksida dengan kehadiran asid sulfurik.
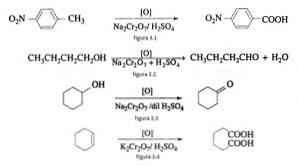
Sebagai contoh pengoksidaan p-nitrotoluene untuk membentuk p-nitrobenzoic asid, dalam pengoksidaan n-butanol untuk membentuk n-butaldehido, dalam pembentukan sikloheksanon dari sikloheksanol dan pembentukan asid adipic seperti yang ditunjukkan dalam Rajah 3.1 , Masing-masing 3.2, 3.3 dan 3.4 (VK Ahluwalia, 2004).
Biokimia
Penjanaan beransur-ansur intratracheal natrium dikromat (CrVI) dan kromium acetate hidroksida (CrIII) pada tikus lelaki mengakibatkan peningkatan kepekatan kromium adalah darah keseluruhan, plasma dan air kencing sehingga 72 jam selepas pendedahan; Kepekatan maksimum telah dicapai pada 6 jam selepas pendedahan.
Nisbah antara kromium darah dan kepekatan kromium plasma sangat berbeza dengan rawatan Cr (VI) dan Cr (III). Oleh itu, analisis kromium dalam darah dan kromium dalam plasma perlu digunakan untuk penilaian pendedahan kromium.
Chromium juga dikesan dalam limfosit periferal. Cr (VI), tetapi tidak Cr (III) terkumpul dengan ketara dalam limfosit selepas rawatan. Sel-sel ini mempunyai potensi untuk digunakan sebagai biomarker dalam penilaian pendedahan kepada sebatian kromium (Hooth, 2008).
Rujukan
- Datasheet Kimia Natrium Dichromate. (2016). Diperolehi daripada bahan kimia datang: cameochemicals.noaa.
- Hooth, M. J. (2008). Laporan Teknikal mengenai Kajian Toksikologi dan Karsinogenesis Natrium Dichromate Dihydrated. Institut Kesihatan Negara Amerika Syarikat.
- Kogel, J. E. (2006). Mineral & Batu Perindustrian: Komoditi, Pasaran, dan Penggunaan edisi ketujuh. littleton colorado: masyarakat perlombongan, metallurgyc dan penerokaan inc.
- Pusat Kebangsaan Maklumat Bioteknologi. (s.f.). Pangkalan Data Kompaun PubChem; CID = 25408. Diperolehi daripada pubchem.com: pubchem.ncbi.nlm.nih.gov.
- Jabatan Kesihatan New Jersey. (2009, November). lembaran fakta bahan natrium dikromat. Diperoleh dari nj.gov: nj.gov.
- Natrium dikromat. Blok bangunan untuk hampir semua sebatian kromium lain. (2010-2012). Diperoleh dari unsuris kromium: elementischromium.com
- K. Ahluwalia, R. A. (2004). Kimia Organik Praktikal Komprehensif: Persediaan Dan Analisa Kuantitatif. Delhi: Press Universiti (India).


