Apakah atom neutral? (Dengan contoh)
A atom neutral adalah yang tidak mempunyai caj elektrik disebabkan pampasan antara bilangan proton dan elektronnya. Kedua-duanya adalah zarah subatomik yang dikenakan elektrik.
Proton dikelompokkan di sebelah neutron, dan membentuk nukleus; manakala elektron tersebar dengan mendefinisikan awan elektronik. Apabila bilangan proton dalam atom, bersamaan dengan nombor atomnya (Z), sama dengan bilangan elektron, dikatakan terdapat pampasan antara caj elektrik dalam atom.
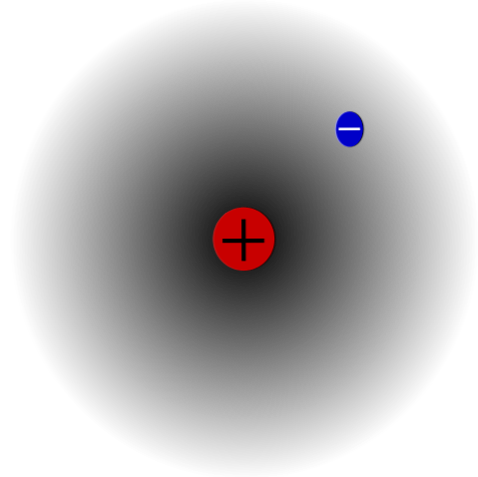
Contohnya, ada atom hidrogen (imej atas), yang mempunyai proton dan elektron. Proton diposisikan di pusat atom sebagai nukleusnya, sementara elektron mengorbit ruang sekelilingnya, meninggalkan kawasan ketumpatan elektron yang lebih rendah kerana ia bergerak dari nukleus.
Ini adalah atom neutral kerana adalah benar bahawa Z adalah sama dengan bilangan elektron (1p = 1e). Jika atom H hilang proton tunggal, jejari atom akan mengecut dan caj proton akan diguna pakai, menjadi kation H.+ (hidron). Jika, sebaliknya, ia mendapat elektron, akan ada dua elektron dan ia akan menjadi anion H-- (hidrida).
Indeks
- 1 atom neutral vs ion
- 1.1 Na vs Na+
- 2 molekul neutral
- 3 Contoh
- 3.1 Oksigen
- 3.2 Tembaga
- 3.3 Gas mulia
- 3.4 Aloi logam
- 4 Rujukan
Atom vs ion neutral
Untuk contoh atom neutral H, didapati bahawa bilangan proton sama dengan bilangan elektron (1p = 1e); keadaan yang tidak berlaku dengan ion yang diperolehi oleh kehilangan atau keuntungan elektron.
Ion dibentuk oleh perubahan dalam bilangan elektron, sama ada kerana atom memenanginya (-) atau kehilangannya (+).
Dalam atom kation H+ Tuduhan valensi proton bersendirian mendominasi di hadapan tidak adanya elektron (1p> 0e). Ini adalah benar untuk semua atom berat lain (np> ne) jadual berkala.
Walaupun kehadiran tuduhan positif mungkin kelihatan tidak penting, ia berubah secara menyerong ke ciri-ciri elemen yang dipersoalkan.
Sebaliknya, dalam atom anion H- Tuntutan negatif kedua-dua elektron ini mendominasi di hadapan proton teras tunggal (1p<2e). Igualmente, los demás aniones de mayor masa tienen un exceso de electrones en comparación al número de protones (np
Na vs Na+
Satu contoh yang lebih baik ialah natrium metalik. Atom neutral, Na, dengan Z = 11, mempunyai 11 proton; oleh itu, mesti ada 11 elektron untuk mengimbangi caj positif (11p = 11e).
Natrium, menjadi elemen logam, sangat elektropositif, sangat mudah kehilangan elektron; dalam kes ini, dia kehilangan hanya satu, iaitu shell valensnya (11p> 10e). Oleh itu, kation Na dibentuk+, yang berinteraksi secara elektrostatik dengan anion; seperti klorida, Cl-, dalam garam natrium klorida, NaCl.
Natrium logam adalah beracun dan menghakis, sementara kationnya juga terdapat di dalam sel-sel. Ini menunjukkan bagaimana sifat-sifat sesuatu unsur boleh berubah secara drastik apabila ia meraih atau kehilangan elektron.
Sebaliknya, anion Na- (soduro, hipotesis) tidak wujud; dan dapat membentuk, ia akan menjadi sangat reaktif, kerana ia bertentangan dengan sifat kimia natrium untuk mendapatkan elektron. The Na- akan mempunyai 12 elektron, melepasi caj positif nukleusnya (11p<12e).
Molekul neutral
Atom dikaitkan kovalen untuk menimbulkan molekul, yang juga boleh dipanggil sebatian. Tidak boleh ada ion terasing dalam molekul; Sebaliknya, ada atom yang mempunyai tuduhan formal atau negatif. Atom yang dikenakan ini mempengaruhi cas bersih molekul, mengubahnya menjadi ion polyatomik.
Untuk molekul menjadi neutral, jumlah caj rasmi atomnya mestilah sama dengan sifar; atau, lebih mudah, semua atomnya adalah neutral. Jika atom yang membentuk molekul adalah neutral, ini juga akan menjadi.
Sebagai contoh, anda mempunyai molekul air, H2O. Dua atom Hnya adalah neutral, sama seperti atom oksigen. Mereka tidak boleh diwakili dengan cara yang sama seperti yang ditunjukkan dalam imej atom hidrogen; sejak, walaupun inti tidak berubah, awan elektronik tidak.
Ion hidronium, H3O+, Sebaliknya, ia mempunyai atom oksigen dengan cas positif separa. Ini bermakna bahawa dalam ion polyatomik itu kehilangan elektron, dan oleh itu bilangan protonnya lebih tinggi daripada elektronnya.
Contohnya
Oksigen
Atom oksigen neutral mempunyai 8 proton dan 8 elektron. Apabila ia memperoleh dua elektron, ia membentuk apa yang dikenali sebagai anion oksida, ATAU2-. Di dalamnya, caj negatif menguasai, mempunyai lebihan dua elektron (8p<10e).
Atom oksigen neutral mempunyai kecenderungan yang tinggi untuk bertindak balas dan mengikat diri mereka untuk membentuk O2. Oleh sebab itu, tidak ada atom atau "longgar" di sana untuk nasib mereka dan tanpa bertindak balas dengan apa-apa. Semua tindak balas yang diketahui untuk gas ini dikaitkan dengan oksigen molekul, ATAU2.
Tembaga
Tembaga mempunyai 29 proton dan 29 elektron (selain neutron). Tidak seperti oksigen, atom neutralnya dapat ditemui secara alamiah kerana ikatan besi dan kestabilan relatifnya.
Seperti natrium, ia cenderung kehilangan elektron dan bukan memenanginya. Memandangkan konfigurasi elektronik dan aspek lain, ia boleh kehilangan satu atau dua elektron, menjadi kation cuprous, Cu+, atau cuprik, Cu2+, masing-masing.
Kation Cu+ mempunyai satu elektron kurang (29p<28e), y el Cu2+ telah kehilangan dua elektron (29 p<27e).
Gas mulia
Gas-gas mulia (He, Ne, Ar, Kr, Xe, Rn), adalah salah satu daripada beberapa unsur yang wujud dalam bentuk atom neutral mereka. Nombor atom mereka ialah: 2, 10, 18, 36, 54 dan 86. Mereka tidak mendapat atau kehilangan elektron; walaupun, Xenon, Xe, boleh membentuk sebatian dengan fluorin dan kehilangan elektron.
Aloi logam
Logam, jika dilindungi daripada kakisan, boleh mengekalkan atom neutral mereka, yang dikaitkan dengan ikatan logam. Dalam aloi, penyelesaian pepejal logam, atom kekal (kebanyakannya) neutral. Di dalam tembaga, sebagai contoh, terdapat atom neutral Cu dan Zn.
Rujukan
- Jetser Carasco. (2016). Apakah atom neutral? Diperolehi daripada: introduction-to-physics.com
- Markings, Samuel. (25 April 2017). Contoh-contoh Atom Bukan Neutral. Saintifik. Diperolehi daripada: sciencing.com
- Chem4kids. (2018) Melihat Ion. Diperolehi daripada: chem4kids.com
- Whitten, Davis, Peck & Stanley. (2008). Kimia (Ed ed.). Pembelajaran CENGAGE.
- Shiver & Atkins. (2008). Kimia anorganik (Edisi keempat). Mc Graw Hill.


