Garam organik sifat fizikal dan kimia, kegunaan dan contoh
The garam organik mereka adalah sebatian padat ionik dengan ciri-ciri tak terhitung. Mereka memperolehnya sebelum ini dari sebatian organik, yang telah mengalami transformasi yang membolehkan ia menjadi pembawa tuduhan, dan juga, identiti kimianya bergantung kepada ion yang berkaitan.
Dalam imej di bawah dua rumus kimia yang sangat umum untuk garam organik ditunjukkan. Yang pertama, R-AX, ditafsirkan sebagai sebatian di mana struktur karbonnya atom, atau kumpulan A, membawa tuduhan positif + atau negatif (-).
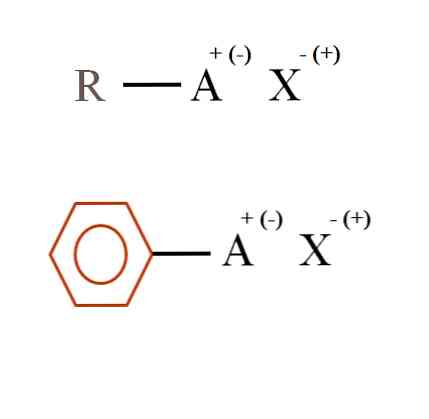
Seperti yang ditunjukkan, terdapat satu ikatan kovalen antara R dan A, R-A, tetapi sebaliknya, A mempunyai cas formal yang menarik (atau menangkis) X. ion Tanda caj bergantung kepada jenis A dan persekitaran kimia.
Jika A adalah positif, berapa X bolehkah ia berinteraksi? Dengan hanya satu, diberi prinsip electroneutrality (+ 1-1 = 0). Walau bagaimanapun, apakah identiti X? Anion X boleh menjadi CO32-, memerlukan dua kation RA+; halogenida: F-, Cl-, Br-, dsb.; atau bahkan, sebatian lain RA-. Pilihan tidak dapat dikira.
Juga, garam organik boleh mempunyai ciri aromatik, digambarkan dalam cincin benzena coklat. Garam benzoat tembaga (II), (C6H5COO)2Cu, sebagai contoh, terdiri daripada dua cincin aromatik dengan kumpulan karboksil yang bercas negatif, yang berinteraksi dengan Cu kation.2+.
Indeks
- 1 Sifat fizikal dan kimia
- 1.1 Berat molekul tinggi
- 1.2 Amphipil dan surfaktan
- 1.3 Titik mendidih atau lebur tinggi
- 1.4 Keasidan dan asas
- 2 Kegunaan
- 3 Contoh garam organik
- 3.1 Carboxylates
- 3.2 Lithium diacryluprates
- 3.3 Salutan sulfonium
- 3.4 Garam oksonium
- 3.5 garam amina
- 3.6 garam Diazonium
- 4 Rujukan
Sifat fizikal dan kimia
Dari imej, dapat dinyatakan bahawa garam organik terdiri dari tiga komponen: organik, R atau Ar (cincin aromatik), suatu atom atau kumpulan yang mengangkut cas ionik A, dan persamaan X.
Sama seperti identiti dan struktur kimia ditakrifkan oleh komponen tersebut, maka sifatnya bergantung kepada mereka.
Dari fakta ini boleh diringkaskan beberapa sifat umum yang memenuhi sebahagian besar garam ini.
Jisim molekul yang tinggi
Dengan mengandaikan anion X mono atau polyvalen anorganik, garam organik biasanya mempunyai massa molekul yang jauh lebih besar daripada garam anorganik. Hal ini disebabkan oleh kerangka karbon, yang mudah ikatan C-C, dan atom hidrogennya, menyumbang banyak massa ke senyawa.
Oleh itu, mereka adalah R atau Ar yang bertanggungjawab untuk berat molekulnya yang tinggi.
Amphiphiles dan surfactants
Garam organik adalah sebatian amphipilik, iaitu, strukturnya mempunyai kedua-dua hidrofilik dan hidrofobik.
Apakah kelebihan itu? R atau Ar mewakili akhir hidrofobik, kerana atom C dan H mereka tidak mempunyai pertalian besar untuk molekul air.
A+(-), atom atau kumpulan yang membawa pertuduhan, adalah hujung hidrofilik, kerana ia menyumbang kepada masa dipolar dan berinteraksi dengan air yang diboles dipoles (RA+ OH2).
Apabila kawasan hidrofilik dan hidrofobik dipolarisasikan, garam amphipilik itu menjadi surfaktan, bahan yang banyak digunakan untuk pembuatan bahan cuci dan demulsifiers.
Titik mendidih atau lebur yang tinggi
Seperti garam anorganik, garam organik juga mempunyai takat lebur dan takat didih tinggi, kerana daya elektrostatik yang mengawal fasa cecair atau pepejal.
Walau bagaimanapun, mempunyai komponen organik R atau Ar, jenis lain dari pasukan Van der Waals (pasukan London, dipole-dipole, hidrogen jambatan) yang bersaing dengan cara tertentu dengan elektrostatik.
Atas sebab ini, struktur pepejal atau cecair garam organik adalah, pada mulanya, lebih kompleks dan bervariasi. Ada di antara mereka yang boleh bertindak seperti itu kristal cecair.
Keasidan dan asasnya
Garam organik biasanya asid atau asas kuat daripada garam tak organik. Ini adalah kerana A, misalnya dalam garam amina, mempunyai caj positif kerana ikatan dengan hidrogen tambahan: A+-H. Kemudian, bersentuhan dengan pangkalan, dermakan proton untuk kembali menjadi sebatian neutral:
RA+H + B => RA + HB
H adalah kepunyaan A, tetapi ia ditulis kerana ia campur tangan dalam tindak balas peneutralan.
Sebaliknya, RA+ ia mungkin molekul yang besar, tidak dapat membentuk pepejal dengan rangkaian kristal yang cukup stabil dengan anion hidroksil atau OH hidroksil-.
Apabila ini berlaku, garam RA+OH- ia berperanan seperti pangkalan yang kuat; walaupun sebagai asas seperti NaOH atau KOH:
RA+OH- + HCl => RACl + H2O
Perhatikan dalam persamaan kimia yang anion Cl- ia menggantikan OH-, membentuk garam RA+Cl-.
Kegunaan
Penggunaan garam organik akan berbeza-beza mengikut identiti R, Ar, A dan X. Selanjutnya, aplikasi yang mereka ditakdirkan juga bergantung kepada jenis pepejal atau cecair yang mereka bentuk. Sesetengah umum dalam hal ini adalah:
-Mereka berfungsi sebagai bahan reagen untuk sintesis sebatian organik lain. RAX boleh bertindak sebagai "penderma" rantai R yang akan ditambah ke sebilangan lagi menggantikan kumpulan keluar yang baik.
-Mereka adalah surfaktan, jadi mereka juga boleh digunakan sebagai pelincir. Garam logam karboksilat digunakan untuk tujuan ini.
-Mereka membenarkan untuk mensintesis pelbagai jenis pewarna.
Contoh garam organik
Carboxylates
Asid karboksilat bertindak balas dengan hidroksida dalam tindak balas peneutralan, menimbulkan garam karboksilat: RCOO- M+; di mana M+ Ia boleh menjadi kation logam (Na+, Pb2+, K+, dll) atau NH ammonium kation4+.
Asid lemak adalah asid karboksilat alifatik yang panjang, mereka boleh tepu dan tak tepu. Asid palmitik (CH) adalah antara tepu3(CH2)14COOH). Ini berasal garam palmitat, manakala asid stearic (CH3(CH2)16COOH membentuk garam stearat. Sabun terdiri daripada garam ini.
Dalam kes asid benzoik, C6H5COOH (di mana C6H5- ia adalah cincin benzena), apabila ia bertindak balas dengan asas membentuk garam benzoat. Dalam semua karboksilat, kumpulan -COO- mewakili A (RAX).
Lithium diacupuprates
Lithium diacuprate berguna dalam sintesis organik. Rumusannya ialah [R-Cu-R]-Li+, di mana atom tembaga membawa muatan negatif. Di sini, tembaga mewakili atom A dari imej.
Garam sulphonium
Ia terbentuk daripada tindak balas sulfida organik dengan alkil halida:
R2S + R'X => R2R'S+X
Bagi garam ini, atom sulfur membawa caj rasmi yang positif (S+) yang mempunyai tiga ikatan kovalen.
Garam Oxonium
Juga, eter (analogi oksigen dari sulfida) bertindak balas dengan hidrokida untuk membentuk garam oksonium:
ROR '+ HBr <=> RO+HR '+ Br-
Proton asid HBr secara kovalen terikat kepada atom oksigen daripada eter (R2O+-H), memuatkannya secara positif.
Garam amina
Amina boleh menjadi primer, sekunder, tertiari atau kuaternari, serta garam mereka. Kesemua mereka dicirikan dengan mempunyai atom H yang dikaitkan dengan atom nitrogen.
Jadi, RNH3+X- ia adalah garam amina utama; R2NH2+X-, amina sekunder; R3NH+X-, amina tertiari; dan R4N+X-, daripada amina kuarine (garam ammonium kuarterner).
Garam Diazonium
Akhirnya, garam diazonium (RN2+X-) atau arildiazonium (ArN)2+X-), mewakili titik permulaan bagi banyak sebatian organik, terutama pewarna azo.
Rujukan
- Francis A. Carey. Kimia Organik (Edisi keenam, halaman 604-605, 697-698, 924). Mc Graw Hill.
- Graham Solomons T.W, Craig B. Fryhle. Kimia Organik. Amines (Edisi ke-10.). Wiley Plus.
- Wikipedia. (2018). Garam (Kimia). Diambil dari: en.wikipedia.org
- Steven A. Hardinger. (2017). Glosari Kimia Organik yang digambarkan: garam. Diperolehi daripada: chem.ucla.edu
- Chevron Oronite. (2011). Carboxylates. [PDF] Diperolehi daripada: oronite.com


