Aluminium sulfat (Al2 (SO4) 3) struktur, kegunaan, jenis, ketoksikan
The aluminium sulfat adalah garam aluminium bukan organik formula Al2(SO4)3, yang biasanya muncul sebagai pepejal putih dengan kristal berkilat. Warna kompaun itu akan dipengaruhi oleh kepekatan besi dan sebarang kekotoran lain. Terdapat dua jenis sulfat aluminium utama: A dan B.
Dalam imej yang lebih rendah, kristal putih aluminium sulfat terhidrat ditunjukkan. Ketiadaan warna coklat, menunjukkan ion besi dalam kisi kristal, boleh diperhatikan.

Aluminium sulfat adalah garam yang sangat larut dalam air dan secara semulajadi ia jarang ditemui dalam bentuk anhydrousnya. Ia biasanya terhidrasi dalam bentuk aluminium sulfat oktadecahydrate [Al2(SO4)3.18H2O] atau heksadecahydrate [Al2(SO4)3.16H2O].
Begitu juga, ia boleh membentuk garam berganda dengan kalium, dan dengan ammonium, sebatian yang dikenali sebagai alum. Sebahagiannya mungkin disebabkan oleh pertalian air dalam hidrat untuk mengekalkan ion lain selain aluminium.
Sulfat aluminium boleh diuraikan oleh tindakan air dalam aluminium hidroksida dan asid sulfurik. Harta ini membenarkan penggunaannya sebagai pengasidan tanah.
Ia juga merupakan sebatian toksik, terutamanya dengan sentuhan dengan serbuknya. Walau bagaimanapun, ia mempunyai infiniti kegunaan dan aplikasi yang keluar dari pemurnian air dengan cara kaedah pembekuan, yang berlaku melalui penggunaannya dalam beberapa industri, sehingga penggunaannya dengan tujuan terapeutik.
Indeks
- 1 Struktur
- 2 Apa gunanya (kegunaan)
- 2.1 Pembekuan atau pemberbukuan air
- 2.2 Digunakan sebagai mordant dakwat dan dalam penghuraian kertas
- 2.3 Kegunaan industri
- 2.4 Penggunaan ubat dan terapeutik
- 2.5 Kegunaan lain
- 3 Pengeluaran aluminium sulfat
- 4 jenis
- 5 Ketoksikan
- 6 Rujukan
Struktur
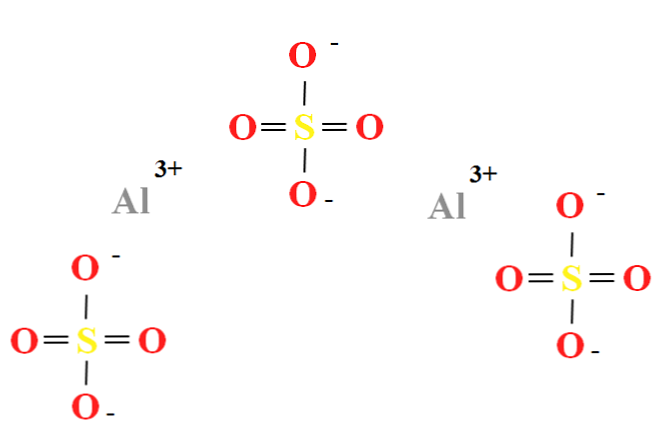
Aluminium sulfat mempunyai nisbah dua kation Al3+ untuk setiap tiga anion SO42- (imej atas), yang boleh dilihat secara langsung dalam formula kimianya Al2(SO4)3.
Perhatikan bahawa Al3+ mereka adalah kelabu, sedangkan SO42- mereka adalah kuning (untuk atom sulfur) dan merah (untuk atom oksigen).
Struktur yang digambarkan bersesuaian dengan bentuk alir Al2(SO4)3, kerana tiada molekul air berinteraksi dengan ion. Walau bagaimanapun, dalam hidrat anda, air boleh tertarik ke pusat positif Al3+, atau oleh SO negatif tetrahedra42- melalui ikatan hidrogen (HOH-O-SO32-).
Al2(SO4)3∙ 18H2Atau, sebagai contoh, ia mengandungi 18 molekul air dalam struktur pepejalnya. Sesetengah daripada mereka mungkin bersentuhan langsung dengan Al3+ atau dengan SO42-. Dengan kata lain: sulfat aluminium boleh mempunyai air koordinasi dalaman atau luaran.
Selain itu, strukturnya boleh menampung kation lain seperti Fe3+, Na+, K+, dsb. Tetapi untuk ini, perlu ada lebih banyak anion SO42-. Untuk apa? Untuk meneutralkan kenaikan caj positif akibat kekotoran logam.
Aluminium sulfat boleh mempunyai banyak struktur, walaupun hidratnya cenderung mengamalkan sistem kristal monoklinik.
Sifat fizikal dan kimia
Rupa
Ia kelihatan sebagai pepejal dengan kristal putih berkilat, butiran atau serbuk.
Berat molekul
342.31 g / mol (anhydrous).
Bau
Ia tidak berbau
Rasa
Rasa manis agak astringen.
Titik lebur
Bentuk 770º C anhydrous (86.5º C octadecahidratada form)
Kelarutan dalam air
31.2 g / 100 ml pada 0 ° C; 36.4 g / 100 ml pada 20 ° C dan 89 g / 100 ml pada 100 ° C.
Ketumpatan
2.67 hingga 2.71 g / cm3.
Kelarutan
Sedikit larut dalam alkohol etil.
Tekanan wap
Pada dasarnya sifar.
Kestabilan
Stabil di udara.
Penguraian
Apabila dipanaskan, kira-kira kira-kira takat leburnya, ia boleh terurai dengan mengeluarkan terutamanya sulfur oksida, gas toksik.
Kerosakan
Penyelesaian aluminium sulfat menghancurkan kepada aluminium. Juga sebatian boleh menghancurkan logam dengan kehadiran kelembapan.
pKa
3.3 hingga 3.6. Dan pHnya adalah 2.9 atau lebih dalam larutan akueus 5%.
Apa gunanya (kegunaan)
Pembekuan atau pemberbukuan air
-Apabila dicampur dengan air (minum, disampaikan atau sisa), aluminium sulfat berasal hidroksida aluminium, yang kompleks dengan sebatian dan zarah dalam larutan mempercepatkan pemendapan, yang jika tiada rawatan dengan aluminium sulfat mengambil lama.
-Aluminium sulfat juga digunakan dalam pembersihan air kolam renang, menjadikannya lebih menarik untuk digunakan.
-Melalui penggunaan aluminium sulfat, air diperolehi tanpa kekeruhan dan warna, meningkatkan keupayaannya dengan memudahkan pembersihan air. Malangnya kaedah penyucian ini boleh menyebabkan kepekatan aluminium yang sedikit meningkat di dalam air.
-Aluminium adalah logam yang sangat toksik yang terkumpul di kulit, otak dan paru-paru, menyebabkan gangguan yang serius. Di samping itu, tidak diketahui apa fungsi yang dipenuhi dalam makhluk hidup.
-Kesatuan Eropah menghendaki maksimum had aluminium dalam air tidak melebihi 0.2 mg / l. Sementara itu, Agensi Perlindungan Alam Sekitar AS menghendaki bahawa had maksimum pencemaran air dengan aluminium tidak melebihi 0.05-0.2 mg / l.
-Rawatan air kumbahan atau digunakan dengan aluminium sulfat membolehkan penghapusan atau pengurangan fosforus di dalamnya, secara ekonomi.
Gunakan sebagai dakwat tinta dan dalam penghuraian kertas
-Aluminium sulfat telah digunakan sebagai mordant untuk pewarna atau dakwat, membantu untuk menetapkan pada bahan yang akan dicelup. Tindakan penetapannya adalah disebabkan oleh Al (OH)3, yang konsisten gelatin menyumbang kepada penjerapan pewarna pada tekstil.
-Walaupun ia telah digunakan sejak sekitar 2000 SM untuk tujuan yang diterangkan, hanya pewarna organik yang memerlukan morden. Pewarna sintetik, sebaliknya, tidak memerlukan morden untuk memenuhi fungsi mereka.
-Ia telah dipindahkan dari pembuatan kertas, tetapi ia masih digunakan dalam pengeluaran pulpa kertas. Mengeluarkan kekotoran, dan juga telah digunakan untuk mengikat bahan, meneutralkan cas dan menentukurkan rosin.
Kegunaan industri
-Ia digunakan dalam industri pembinaan untuk mempercepatkan penetapan konkrit. Selain itu, ia digunakan dalam kalis air bangunan.
-Dalam industri sabun dan lemak, ia digunakan dalam pengeluaran gliserin.
-Ia digunakan dalam industri minyak dalam pembuatan pemangkin sintetik yang digunakan semasa operasi.
-Ia digunakan dalam industri farmaseutikal sebagai penyumbang dadah dan kosmetik.
-Mengeluh dalam pengeluaran pewarna seperti carmine. Ia juga digunakan sebagai pewarna dalam pembuatan karet sintetik butadiena stirena.
-Dalam industri pembuatan gula ia digunakan sebagai pembersih molases untuk tebu.
-Ia digunakan dalam pembuatan deodoran. Mengapa? Kerana menyebabkan penyempitan saluran kelenjar sudoríperas, dengan itu menghadkan pengumpulan peluh, cara yang perlu untuk pertumbuhan bakteria yang menyebabkan bau busuk.
-Ia digunakan dalam penyamakan kulit, proses yang diperlukan untuk kegunaannya. Selain itu, ia digunakan dalam pembuatan baja.
-Ia digunakan sebagai bahan tambahan dalam penyediaan cat, pelekat dan pengedap, serta produk pembersihan dan penjagaan untuk perabot..
Penggunaan ubat dan terapeutik
-Aluminium sulfat adalah yg membantu imunologi. Oleh itu, ia memenuhi fungsi pemprosesan antigen sedemikian rupa bahawa, apabila dibebaskan di tapak tindakan mereka, mereka menghasilkan penghasilan antibodi yang lebih besar untuk antigen yang telah dioleskan.
-Adjuvant Freund dan BCG, serta adjuvants lain, termasuk antigen-antigen seperti interleukin, tidak spesifik untuk antigen, membolehkan peningkatan radius tindakan imun. Ini telah membolehkan pembangunan pelbagai penyakit vaksin keburukan.
-Tindakan koagulasi sulfat aluminium telah membolehkan penghapusan pelbagai virus dalam air terawat, antara lain: Q beta, MS2, T4 dan P1. Hasilnya menunjukkan bahawa rawatan air dengan sulfat aluminium menghasilkan penyebaran virus sedemikian.
-Aluminium sulfat digunakan dalam bentuk kayu atau sebagai serbuk dalam rawatan luka-luka kecil yang kecil atau lecet yang dihasilkan semasa bercukur.
-Ia digunakan dalam pembuatan aluminium asetat, sebatian yang digunakan dalam rawatan beberapa keadaan telinga. Ia juga telah digunakan, tanpa kejayaan yang ketara, untuk mengurangkan kesan gigitan semut api..
-Penyelesaian aluminium sulfat digunakan, pada kepekatan 5% hingga 10%, dalam rawatan ulser tempatan yang membolehkan kawalan rembesan mereka.
-Tindakan astringent aluminium sulfat menggabungkan lapisan dangkal kulit, membekalkan protein dan menyembuhkan luka.
Kegunaan lain
-Aluminium sulfat membantu dalam mengawal pertumbuhan alga dalam kolam, tasik dan aliran air. Ia juga digunakan dalam penyingkiran moluska, antara lain slug Sepanyol.
-Perkebunan memohon sebatian ini untuk menghasut tanah alkali. Dalam hubungan dengan airnya, sulfat aluminium dibusukkan menjadi aluminium hidroksida dan mencairkan asid sulfurik. Kemudian, hidroksida aluminium menjejaskan, meninggalkan asid sulfurik dalam larutan.
-Pengasidan tanah disebabkan oleh asid sulfurik dipaparkan dengan cara yang kreatif, kerana kewujudan tumbuhan yang dipanggil Hydrangea, yang bunga bertukar menjadi biru di hadapan sebuah tanah asid; iaitu peka dan responsif kepada perubahan pH.
-Aluminium sulfat terlibat dalam pengeluaran buih untuk memerangi dan mengawal kebakaran. Bagaimana? Bertindak balas dengan natrium bikarbonat, mengeluarkan pelepasan CO2. Blok gas ini akses O2 ke tapak pembakaran bahan; dan seterusnya gencatan senjata yang sedang berkembang.
Pengeluaran aluminium sulfat
Aluminium sulfat disintesis dengan bertindak balas dengan sebatian kaya aluminium, seperti bijih bauksit, dengan asid sulfurik pada suhu tinggi. Persamaan kimia berikut mewakili reaksi:
Al2O3 + H2SO4 -> Al2(SO4)3 + 3 H2O
Aluminium sulfat juga boleh dibentuk oleh tindak balas peneutralan antara aluminium hidroksida dan asid sulfurik, mengikut tindak balas berikut:
2 Al (OH)3 + 3 H2SO4 + 12 H2O -> Al2(SO4)3.18H2O
Asid sulfurik bertindak balas dengan aluminium untuk membentuk amonium sulfat dan pelepasan molekul hidrogen dalam bentuk gas. Reaksi ini dijangkakan seperti berikut:
2 Al + 3 H2SO4 -> Al2(SO4)3 + 3 H2
Jenis
Aluminium sulfat dikelaskan kepada dua jenis: jenis A dan jenis B. Dalam aluminium sulfat jenis A, pepejal putih dan mempunyai kepekatan besi kurang daripada 0.5%.
Dalam aluminium sulfat jenis B, pepejal adalah coklat dan mempunyai kepekatan besi kurang daripada 1.5%.
Terdapat industri yang menghasilkan aluminium sulfat yang mempunyai kriteria yang berbeza untuk klasifikasi mereka. Oleh itu, laporan industri untuk penyediaan jenis aluminium sulfat aluminium kepekatan maksimum 0.1% besi sebagai ferric oxide. Sedangkan untuk jenis B mereka menunjukkan kepekatan besi maksimum sebanyak 0.35%.
Ketoksikan
-Aluminium sulfat adalah sebatian yang menimbulkan tindakan toksiknya dengan bersentuhan dengan debunya, sehingga menyebabkan kerengsaan kulit, dan dalam kes-kes di mana hubungannya kerap, dermatitis.
-Di mata ia menyebabkan kerengsaan yang kuat, walaupun untuk menghasilkan kecederaan kekal.
-Penyedutan menyebabkan kerengsaan hidung dan tekak, yang boleh menyebabkan batuk dan ruam.
-Pengambilannya menyebabkan kerengsaan gastrik, mual dan muntah.
-Terdapat kesan toksik yang walaupun tidak langsung disebabkan aluminium sulfat, ia secara tidak langsung disebabkan oleh penggunaannya. Ini adalah kes kesan toksik tertentu aluminium, yang disebabkan oleh penggunaan aluminium sulfat dalam pemurnian air.
-Pesakit yang secara kronik dialisis dengan menggunakan garam yang disediakan dalam air yang disucikan, melalui penggunaan aluminium sulfat, mengalami gangguan kesihatan yang teruk. Di antara gangguan ini kita mempunyai anemia, demensia oleh dialisis dan peningkatan dalam penyakit tulang.
Rujukan
- Wikipedia. (2018). Aluminium sulfat Diambil dari: en.wikipedia.org
- Aris Industrial Larutan aluminium sulfat jenis A dan B. Diambil dari: aris.com.pe
- Christopher Boyd (9 Jun 2014). Penggunaan Perindustrian Teratas untuk Aluminium Sulfat. Diambil dari: chemservice.com
- PubChem. (2018). Aluminium Sulfate Anhydrous. Diambil dari: pubchem.ncbi.nlm.nih.gov
- Andesia Chemicals (20 Ogos 2009). Lembaran keselamatan aluminium sulfat. [PDF] Diambil dari: andesia.com
- Buku Kimia. (2017). Aluminium Sulfate. Diambil dari: chemicalbook.com


