Formula, Kegunaan, Risiko Natrium Sulfit
The natrium sulfida (Na2S) adalah pepejal kristal dari kuning ke batu bata merah. Secara semulajadi ia didapati dalam darjah penghidratan yang berbeza, yang paling biasa adalah natrium sulfida nonahydrate (Na2S · 9H2O).
Mereka adalah garam larut air yang memberikan penyelesaian yang sangat alkali. Apabila terdedah kepada udara yang lembap, mereka menyerap kelembapan dari udara, yang boleh memanaskan secara spontan dan menyebabkan pencucuhan bahan mudah terbakar yang berdekatan. Begitu juga dengan udara lembap, mereka mengeluarkan hidrogen sulfida, yang berbau seperti telur busuk.

Mereka adalah agen pengurangan yang kuat. Bahan-bahan ini boleh berbahaya bagi alam sekitar, terutamanya bagi organisma akuatik.
Sodium monosulfide tersedia secara komersil dalam bentuk serpihan yang mengandungi 60-62% Na2S ...
- Formula

- CAS: 1313-82-2 Natrium sulfida (anhydrous)
- CAS: 1313-84-4 Natrium sulfida (tidak dihidrasi)
Struktur 2D
Struktur 3D
Ciri-ciri natrium sulfida
Sifat fizikal dan kimia

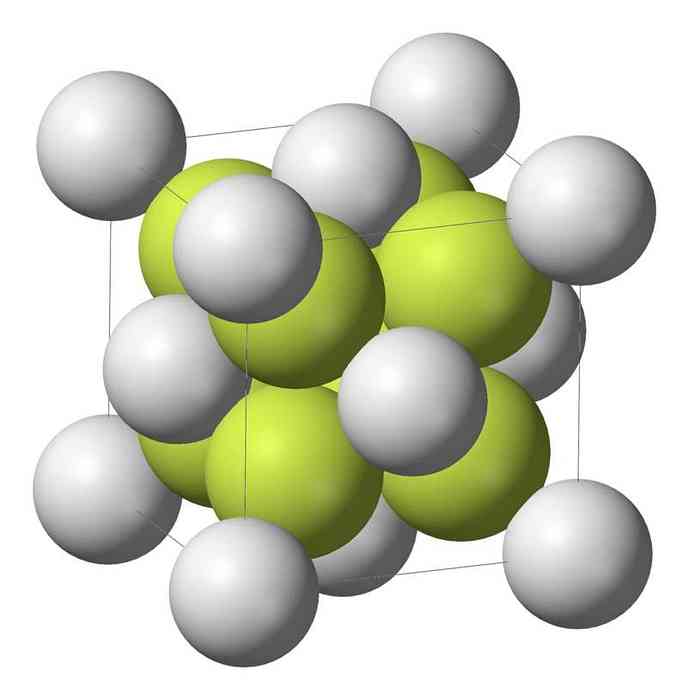
Sodium monosulfide (Na2S) crystallizes dengan struktur antifluorite, di mana setiap atom S dikelilingi oleh hub 8 atom Na dan setiap atom Na oleh tetrahedron empat atom S.
Kemudahbakaran
Satu-satunya ahli yang mudah terbakar dalam kumpulan sulfida tak organik ialah hidrogen sulfida. Walau bagaimanapun, sesetengah sulpid bukan organik lain, seperti natrium sulfida, boleh secara spontan memanaskan dan bahkan menyala jika terdedah kepada kelembapan..
Apabila terdedah kepada kebakaran, natrium sulfida mengeluarkan gas atau wap sulfur dioksida, yang menjengkelkan atau toksik.
Reaktiviti
- Sulfida bukan organik umumnya asas (sesetengahnya sangat asas, dan oleh itu tidak sesuai dengan asid).
- Ramai sebatian ini mengurangkan agen (mereka bertindak balas dengan kuat dengan agen pengoksida).
- Sulfida garam mudah (seperti sulfida natrium, kalium dan ammonium) bertindak balas dengan bersungguh-sungguh dengan asid untuk membebaskan gas hidrogen sulfida, sangat toksik dan mudah terbakar.
- Natrium sulfida mudah terbakar. Boleh meletup apabila dipanaskan dengan cepat atau melanda.
- Apabila dipanaskan kepada penguraian, ia mengeluarkan wap toksik natrium oksida dan oksida sulfur.
- Reacts violently with carbon, with arang, diazonium garam, N, N-dichloromethylamine, oxidants kuat, dan air.
Ketoksikan
Ramai ahli kumpulan sulfida anorganik bertindak sebagai pangkalan yang kuat, dan boleh menyebabkan luka bakar yang teruk ketika mereka bersentuhan dengan kulit.
Harta ini bergantung kepada kelarutannya. Sulfida anorganik yang paling tidak larut (contohnya merkuri (II) sulfida dan kadmium sulfida) tidak berkhasiat.
Natrium sulfida mempunyai pekali partisi oktanol / air (Pow) sederhana (-3.5). Nilai ini digunakan sebagai ukuran keterlarutan (dan biokonsentrasi) suatu bahan dalam tisu lemak haiwan (terutamanya haiwan akuatik).
Sodium sulfide dianggap berbahaya kepada alam sekitar, terutamanya bagi organisma akuatik.
Kegunaan
Di rumah, sulfida natrium yang digunakan dalam perlawanan pembukaan longkang, pembersih rumah (untuk ketuhar, bilik mandi), pelurus rambut, pencuci pinggan mangkuk sabun dan beg udara automobil.
Dalam industri, ia digunakan dalam pembersih, dalam simen, dan sebagai pelopor dalam pengeluaran produk kimia lain.
Kesan klinikal
Pendedahan kepada natrium sulfida adalah perkara biasa di negara-negara maju dan negara-negara terbelakang, baik dalam industri maupun di rumah. Bahan menghakis ini terdapat dalam beberapa produk rumah tangga dalam kepekatan rendah.
Di negara-negara maju, kesan serius jarang berlaku. Ini berlaku terutamanya kerana pengambilan bahan kimia yang disengajakan pada orang dewasa. Walau bagaimanapun, di negara-negara membangun, kesan yang serius adalah lebih biasa.
Corrosin alkali menyebabkan nekrosis akibat pencairan. Saponify lemak dalam membran sel, memusnahkan sel dan membolehkan penembusan dalam ke dalam tisu membran mukus.
Pendedahan oral
Keradangan awal berlaku di dalam tisu gastrointestinal, diikuti dengan tisu nekrosis (dengan penembusan yang mungkin), maka granulasi dan akhirnya pembentukan stenosis.
Pesakit dengan pengambilan yang ringan akan mengalami kerengsaan atau gred yang terbakar (hiperemia dangkal dan edema) dari oropharynx, esophagus atau perut.
Pesakit dengan intoksikasi sederhana boleh mengalami pembakaran gred II (lepuh, erosi dan ulser yang superfisial) dengan kemungkinan pembentukan stenosis (terutamanya esophageal).
Sesetengah pesakit (terutamanya kanak-kanak kecil) mungkin mengalami edema di bahagian atas saluran pernafasan.
Pesakit dengan keracunan lisan yang teruk boleh membangunkan terbakar dalam dan nekrosis mukosa gastrousus, dengan komplikasi seperti perforation (esophageal, perut, masa yang jarang berlaku duodenum), fistulas (tracheoesophageal, aortoesophageal) dan pendarahan gastrousus.
boleh membangunkan hypotension, tachycardia, tachypnea, pembentukan penyempitan (terutamanya esophageal), carcinoma esophageal dan edema pada saluran pernafasan atas (yang biasa dan sering mengancam nyawa).
Keracunan yang teruk pada umumnya terhad kepada pengambilan yang disengajakan pada orang dewasa.
Pendedahan melalui penyedutan
Pendedahan ringan boleh menyebabkan batuk dan bronkospasme.
Penyedutan teruk boleh menyebabkan edema saluran pernafasan atas, terbakar, stridor, dan, jarang, kecederaan paru-paru akut.
Pendedahan mata
Ia boleh menghasilkan kerengsaan dan kemoterapi konjungtiva yang teruk, kecacatan epitel kornea, iskemia limbik, kehilangan visual kekal dan dalam keadaan perforasi yang teruk..
Pendedahan kulit
Pendedahan ringan menyebabkan kerengsaan dan ketebalan separa terbakar. Asidosis metabolik boleh berlaku pada pesakit yang mengalami luka bakar atau kejutan yang teruk.
Pendedahan berpanjangan atau produk tumpuan yang tinggi boleh menyebabkan ketebalan total terbakar.
Keselamatan dan Risiko
Pernyataan Bahaya Sistem yang Diharmonikan Secara Global untuk Klasifikasi dan Pelabelan Bahan Kimia (SGA)
The Global Harmonized System bagi Pengelasan dan Pelabelan Bahan Kimia (GHS) adalah sistem dipersetujui di peringkat antarabangsa, yang dicipta oleh Bangsa-Bangsa Bersatu dan direka untuk menggantikan pelbagai piawaian klasifikasi dan pelabelan yang digunakan di negara-negara yang berbeza dengan menggunakan kriteria konsisten secara global.
kelas bahaya (dan bab yang sepadan daripada GHS) Piawaian klasifikasi dan pelabelan dan cadangan untuk natrium sulfida adalah (Chemicals Agensi Eropah, 2017; United Nations, 2015; PubChem, 2017):







Rujukan
- Benjah-bmm27, (2006). Fluorite-unit-cell-3D-ionic [image] Diperolehi daripada: wikipedia.org.
- ChemIDplus, (2017). 1313-82-2 [image] Diperolehi daripada: chem.nlm.nih.gov.
- ChemIDplus, (2017). Struktur 3D 1313-82-2 - Natrium sulfida [imej] Diperolehi daripada: chem.nlm.nih.gov.
- ChemIDplus, (2017). Struktur 3D 1313-84-4 - Natrium sulfida [imej] Diperolehi daripada: chem.nlm.nih.gov.
- European Chemicals Agency (ECHA). (2017). Ringkasan Klasifikasi dan Pelabelan.
- Klasifikasi harmonis - Lampiran VI Peraturan (EC) No 1272/2008 (Peraturan CLP). Natrium sulfida. Diperoleh pada 16 Januari 2017, dari: echa.europa.eu.
- European Chemicals Agency (ECHA). (2017). Ringkasan Klasifikasi dan Pelabelan.
- Klasifikasi dan pelabelan yang diberi notis. Natrium sulfida, terhidrasi. Diperoleh pada 16 Januari 2017, dari: echa.europa.eu.
- Bank Data Zat Berbahaya (HSDB). TOXNET (2017). Sodium sulfid. Bethesda, MD, EU: Perpustakaan Perubatan Negara. Diperolehi daripada: toxnet.nlm.nih.gov.
- Lange, L., & Triebel, W. (2000). Sulfida, Polysulfides, dan Sulfan. Dalam Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA. Diperolehi daripada dx.doi.org.
- Pertubuhan Bangsa-Bangsa Bersatu (2015). Sistem Harmonized di Dunia untuk Klasifikasi dan Pelabelan Produk Kimia (SGA) Keenam Edisi Semakan. New York, Amerika Syarikat: Penerbitan Pertubuhan Bangsa-Bangsa. Diperolehi daripada: unece.org.
- Pusat Kebangsaan Maklumat Bioteknologi. Pangkalan Data Kompaun PubChem. (2016). Sodium Sulfide enneahydrate - Struktur PubChem [imej] Diperolehi daripada: pubchem.ncbi.nlm.nih.gov.
- Pusat Kebangsaan Maklumat Bioteknologi. Pangkalan Data Kompaun PubChem. (2017). Natrium monosulfida. Bethesda, MD, EU: Perpustakaan Perubatan Negara. Diperolehi daripada: pubchem.ncbi.nlm.nih.gov.
- Pusat Kebangsaan Maklumat Bioteknologi. Pangkalan Data Kompaun PubChem. (2017). Sodium Sulfide enneahydrate. Bethesda, MD, EU: Perpustakaan Perubatan Negara. Diperolehi daripada: pubchem.ncbi.nlm.nih.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Datasheet Kimia. Natrium sulfida, anhidrat. Perak Spring, MD. EU; Diperolehi daripada: cameochemicals.noaa.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Datasheet Kumpulan Reaktif. Sulfida, Bukan organik. Perak Spring, MD. EU; Diperolehi daripada: cameochemicals.noaa.gov.
- Ondřej Mangl, (2007). Sulfid sodný - Na2S [image] Diperolehi daripada: wikipedia.org.
- PubChem, (2016). Sodium monosulfide [image] Diperolehi daripada: puchem.nlm.nih.gov.
- PubChem, (2016). Sodium Sulfide enneahydrate [image] Diperolehi daripada: puchem.nlm.nih.gov.
- Wikipedia. (2017). Pekali partisi air-Octanol. Diperoleh pada 17 Januari 2017, dari: wikipedia.org.
- Wikipedia. (2017). Natrium sulfida. Diperoleh pada 17 Januari 2017, dari: wikipedia.org.


