Teori Sea of Electrons Fundamentals, Properties and Disadvantages
The teori elektron elektron Ini adalah hipotesis yang menerangkan fenomena kimia yang luar biasa yang berlaku dalam ikatan logam antara unsur-unsur dengan elektronegativiti rendah. Ini adalah mengenai perkongsian elektron antara atom-atom yang berbeza yang dikaitkan dengan ikatan logam.
Ketumpatan elektronik antara pautan ini adalah sedemikian rupa sehingga elektron diselalogikan dan membentuk "laut" di mana mereka bergerak dengan bebas. Ia juga boleh dinyatakan oleh mekanik kuantum: beberapa elektron (biasanya satu hingga tujuh setiap atom) disusun dalam orbital dengan pelbagai pusat yang diregangkan di permukaan logam.
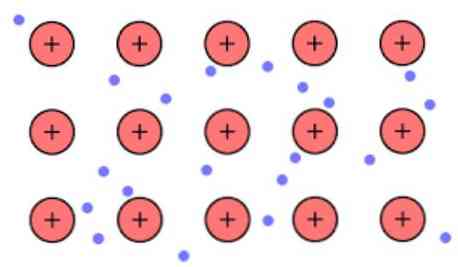
Juga, elektron mengekalkan beberapa lokasi di dalam logam, walaupun pengagihan kebarangkalian awan elektronik mempunyai kepadatan yang lebih tinggi di sekitar beberapa atom tertentu. Ini disebabkan oleh fakta bahawa apabila menggunakan arus tertentu, mereka menunjukkan kekonduksian mereka dalam arah tertentu.
Indeks
- 1 Asas teori laut elektron
- 2 Hartanah
- 2.1 Mengimbangi dalam bentuk lapisan
- 2.2 Teori laut elektron dalam kristal logam
- 3 Kekurangan teori
- 4 Rujukan
Asas teori laut elektron
Unsur-unsur metalik mempunyai kecenderungan besar untuk mendonorkan elektron dari tahap tenaga terakhir mereka (lapisan valensi), kerana daya pengionannya sangat rendah berhubung dengan unsur-unsur lain.
Mengetahui hal ini, setiap elemen logam boleh dipertimbangkan sebagai kation yang dikaitkan dengan elektron tahap tenaga terakhir, yang akan lebih mudah didermakan.
Sebagai logam yang mempunyai sebilangan besar atom yang dihubungkan bersama-sama, ia boleh dianggap bahawa logam membentuk kumpulan kation logam yang tenggelam dalam sejenis laut elektron valens yang mempunyai delocalization besar.
Manakala daya elektrostatik tarikan antara kation (caj positif) dan elektron (caj negatif) mempunyai atom logam terikat kuat membayangkan delocalization elektron valens berkelakuan sebagai pelekat elektrostatik mengekalkan dikaitkan kepada kation logam.
Dengan cara ini, dapat disimpulkan bahawa semakin banyak bilangan elektron yang terdapat dalam lapisan valensi logam, pelekat elektrostatik jenis ini akan mempunyai kekuatan yang lebih besar.
Hartanah
Teori laut elektron menawarkan penjelasan ringkas kepada ciri-ciri spesies metalik seperti rintangan, kekonduksian, kemuluran dan kelemahan, yang berbeza dari satu logam ke yang lain.
Telah ditemui bahawa rintangan yang diberikan kepada logam adalah disebabkan oleh penghapusan elektron mereka yang besar, yang menghasilkan daya perpaduan yang tinggi antara atom-atom yang membentuknya.
Dengan cara ini, kemuluran dikenali sebagai keupayaan bahan-bahan tertentu untuk membolehkan ubah bentuk struktur mereka, tanpa memberi cukup untuk memecahkan, apabila tertakluk kepada daya tertentu.
Offshore dalam bentuk lapisan
Kedua-dua kemuluran dan sifat lunak logam ditentukan oleh fakta bahawa elektron valens adalah delocalized dalam semua arah dalam lapisan, yang menyebabkan mereka untuk bergerak ke atas satu sama lain terhadap tindakan daya luar, mengelakkan pemecahan struktur logam tetapi membenarkan ubah bentuknya.
Begitu juga, kebebasan pergerakan elektron-otorit yang diselalogikan membolehkan aliran arus elektrik, menjadikannya mempunyai kekonduksian sangat baik elektrik.
Di samping itu, fenomena pergerakan bebas elektron ini membolehkan pemindahan tenaga kinetik di antara kawasan logam yang berlainan, yang menggalakkan penghantaran haba dan menyebabkan logam untuk mewujudkan kekonduksian terma yang tinggi.
Teori laut elektron dalam kristal logam
Kristal adalah bahan pepejal yang mempunyai sifat fizikal dan kimia - seperti ketumpatan, titik lebur dan kekerasan - yang ditubuhkan oleh jenis daya yang menjadikan zarah-zarah yang menjadikannya tetap bersama.
Dalam satu cara, dianggap bahawa kristal jenis logam mempunyai struktur paling mudah, kerana setiap "titik" rangkaian kristal telah diduduki oleh suatu atom logam itu sendiri.
Dalam erti kata yang sama, ia telah ditentukan bahawa umumnya struktur kristal logam adalah kubik dan memfokuskan pada muka atau badan.
Walau bagaimanapun, spesies ini juga boleh menjadi hexagonal dalam bentuk dan mempunyai pembungkusan yang agak padat, yang memberikan mereka kepadatan yang sangat besar yang sifatnya.
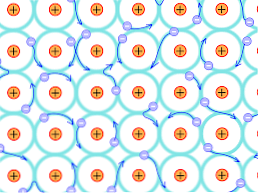
Oleh kerana sebab struktur ini, ikatan yang terbentuk dalam kristal logam adalah berbeza daripada yang berlaku dalam jenis kristal yang lain. Elektron-elektron yang boleh membentuk ikatan-ikatannya diasingkan di seluruh struktur kristal, seperti yang dijelaskan di atas.
Kelemahan teori
Dalam atom logam terdapat sejumlah kecil elektron valensi berkadaran dengan tahap bertenaga mereka; iaitu, terdapat lebih banyak tenaga tenaga yang ada daripada jumlah elektron yang dikaitkan.
Ini menunjukkan bahawa, kerana terdapat delocalization elektron dan tenaga yang kuat band yang telah mengisi sebahagiannya, elektron boleh bergerak melalui struktur kekisi apabila dikenakan dari medan elektrik dari luar, di samping membentuk elektron lautan yang menyokong kebolehtelapan rangkaian.
Oleh itu, kesatuan logam diinterpretasikan sebagai konglomerat ion bermuatan positif ditambah dengan lautan elektron (dikenakan caj negatif).
Walau bagaimanapun, terdapat ciri-ciri yang tidak dijelaskan oleh model ini, seperti pembentukan aloi tertentu antara logam dengan komposisi tertentu atau kestabilan pautan logam kolektif, antara lain..
Ini kelemahan dijelaskan oleh mekanik kuantum, kerana kedua-dua teori ini banyak pendekatan lain telah ditubuhkan berdasarkan model yang paling mudah elektron tunggal, ketika cuba untuk memohon dalam struktur yang lebih kompleks atom multielectron.
Rujukan
- Wikipedia. (2018). Wikipedia. Diambil dari en.wikipedia.org
- Holman, J. S., dan Stone, P. (2001). Kimia Diperoleh dari books.google.com
- Parkin, G. (2010). Metal-Metal Bonding. Diperoleh dari books.google.com
- Rohrer, G. S. (2001). Struktur dan Ikatan dalam Bahan Kristal. Diperoleh dari books.google.com
- Ibach, H., dan Lüth, H. (2009). Fizik Pepejal Negeri: Pengenalan Prinsip Sains Bahan. Diperoleh dari books.google.com


