Struktur karbon, sifat, kegunaan, ketoksikan karbon tetraklorida (CCl4)
The karbon tetraklorida Ia adalah cecair tidak berwarna, dengan bau yang sedikit manis, mirip dengan bau eter dan kloroform. Rumus kimianya adalah CCl4, dan ia merupakan sebatian kovalen dan tidak menentu, yang wapnya lebih ketumpatan daripada udara; Ia tidak kondusif untuk elektrik dan tidak mudah terbakar.
Ia ditemui di atmosfer, air sungai, laut dan sedimen permukaan laut. Diperkirakan bahawa karbon tetraklorida yang terdapat dalam alga merah disintesis oleh organisma yang sama.
Di atmosfer ia dihasilkan oleh tindak balas klorin dan metana. Industri tetrachloride karbon yang dihasilkan secara industri memasuki lautan, terutamanya melalui antara muka laut. Ia telah dianggarkan bahawa aliran atmosfera => lautan adalah 1.4 x 1010 g / tahun, bersamaan dengan 30% daripada jumlah karbon tetraklorida atmosfera.
Indeks
- 1 Ciri-ciri utama
- 2 Struktur
- 3 Sifat fizikal dan kimia
- 4 Kegunaan
- 4.1 Pembuatan kimia
- 4.2 Pembuatan penyejuk
- 4.3 Penindasan api
- 4.4 Pembersihan
- 4.5 Analisis kimia
- 4.6 Spektroskopi inframerah dan resonans magnetik nuklear
- 4.7 Pelarut
- 4.8 Penggunaan lain
- 5 Ketoksikan
- 5.1 mekanisme hepatotoksik
- 5.2 Kesan toksik pada sistem buah pinggang dan sistem saraf pusat
- 5.3 Kesan pendedahan manusia
- 5.4 Interaksi toksik
- 6 Interaksi intermolecular
- 7 Rujukan
Ciri-ciri utama
karbon tetraklorida dihasilkan secara industri daripada pengklorinan haba metana dengan memberi tindak balas metana dengan gas klorin pada suhu antara 400 ° C hingga 430 ° C. Semasa tindak balas produk mentah dijana, dengan sebatian asid hidroklorik.
Ia juga dihasilkan secara industri oleh kaedah disulfida karbon. Klorin dan karbon disulfida direaksikan pada suhu 90 ° C hingga 100 ° C, menggunakan besi sebagai pemangkin. Kemudian, produk mentah dikenakan fraksinasi, peneutralan dan penyulingan.
The CCl4 mempunyai pelbagai kegunaan, antara lain: pelarut lemak, minyak, varnis, dan sebagainya; cucian kering pakaian; racun perosak, dalam fumigasi pertanian dan fungisida dan pengeluaran Nylon. Walau bagaimanapun, walaupun penggunaannya yang besar, penggunaannya telah dikurangkan sebahagiannya disebabkan ketoksikan yang tinggi.
Pada manusia, ia menghasilkan kesan toksik pada kulit, mata dan saluran pernafasan. Tetapi kesannya yang paling berbahaya berlaku dalam berfungsi sistem saraf pusat, hati dan buah pinggang. Kerosakan buah pinggang mungkin penyebab utama kematian akibat tindakan toksik karbon tetraklorida.
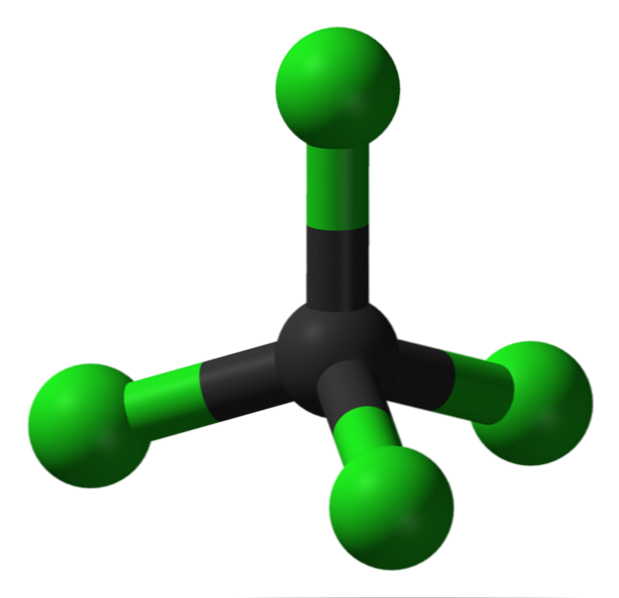
Struktur
Dalam imej, anda dapat melihat struktur karbon tetraklorida, iaitu geometri tetrahedral. Perhatikan bahawa atom Cl (sfera hijau), berorientasikan di ruang sekitar karbon (sfera hitam) dengan menarik tetrahedron.
Juga, adalah perlu disebutkan bahawa kerana semua titik tetrahedron adalah sama, strukturnya adalah simetris; iaitu, tidak kira bagaimana molekul CCl diputar4, Ia akan sentiasa sama. Kemudian, sejak tetrahedron hijau CCl4 adalah simetri, akibat akibat ketiadaan momen dipole kekal.
Mengapa? Kerana walaupun ikatan C-Cl adalah kutub disebabkan oleh elektronegativiti yang lebih besar dari Cl berkenaan dengan C, momen-momen ini dibatalkan secara beransur-ansur. Oleh itu, ia adalah sebatian organik klorinated apolar.
Karbon sepenuhnya berklorin dalam CCl4, apa yang sama dengan pengoksidaan tinggi (karbon boleh membentuk maksimum empat ikatan dengan klorin). Pelarut ini tidak cenderung untuk kehilangan elektron, ia adalah aprotik (ia tidak mempunyai hidrogen), dan ia mewakili cara pengangkutan dan penyimpanan kecil klorin..
Sifat fizikal dan kimia
Formula
CCl4
Berat molekul
153,81 g / mol.
Penampilan fizikal
Ia adalah cecair tidak berwarna. Ia mengkristal dalam bentuk kristal monoklinik.
Bau
Membentangkan bau ciri yang terdapat dalam pelarut klorin yang lain. Baunya aromatik dan agak manis, sama dengan bau tetrakloretilena dan kloroform.
Titik didih
170.1 ºF (76.8 ºC) hingga 760 mmHg.
Titik lebur
-9ºF (-23ºC).
Kelarutan dalam air
Ia tidak larut dalam air: 1.16 mg / mL pada 25ºC dan 0.8 mg / mL pada 20ºC. Mengapa? Kerana air, molekul yang sangat polar, tidak "merasakan" suatu pertalian untuk karbon tetraklorida, yang merupakan apolar.
Kelarutan dalam pelarut organik
Oleh kerana simetri struktur molekulnya, karbon tetraklorida adalah sebatian bukan polar. Oleh itu, ia boleh larut dengan alkohol, benzena, kloroform, eter, karbon disulfida, eter petroleum dan naphtha. Begitu juga, larut dalam etanol dan aseton.
Ketumpatan
Dalam keadaan cair: 1.59 g / ml pada suhu 68 ° F dan 1.594 g / ml pada suhu 20 ° C.
Dalam keadaan pepejal: 1.831 g / ml pada -186 ºC dan 1.809 g / ml pada -80 ºC.
Kestabilan
Secara amnya inert.
Tindakan beracun
Serang beberapa bentuk plastik, karet dan salutan.
Titik pencucuhan
Ia dianggap tidak mudah terbakar, menunjukkan titik pencucuhan kurang dari 982 ºC.
Pencucuhan auto
982 ° C (1800 ° F; 1255 K).
Ketumpatan wap
5.32 berhubung dengan udara, diambil sebagai nilai rujukan bersamaan dengan 1.
Tekanan wap
91 mmHg pada 68 ° F; 113 mmHg pada 77 ºF dan 115 mmHg pada 25 ºC.
Penguraian
Di hadapan api bentuk klorida dan phosgene, sebatian kuat toksik. Demikian juga, di bawah keadaan yang sama ia mengurai menjadi hidrogen klorida dan karbon monoksida. Dengan kehadiran air pada suhu tinggi, ia boleh menyebabkan asid hidroklorik.
Kelikatan
2.03 x 10-3 Pa · s
Ambang ambang
21.4 ppm.
Indeks refraktif (ηD)
1,4607.
Kegunaan
Pembuatan kimia
-Ia bertindak sebagai ejen pengklorinan dan / atau pelarut dalam pembuatan klorin organik. Begitu juga, ia campur tangan sebagai monomer dalam pembuatan Nylon.
-Bertindak sebagai pelarut dalam pembuatan simen getah, sabun dan racun serangga.
-Ia digunakan dalam pembuatan bahan pelarut chlorofluorocarbon.
-Tidak mempunyai pautan C-H, karbon tetraklorida tidak mengalami tindak balas radikal bebas, jadi ia adalah pelarut berguna untuk halogen, sama ada yang halogen rendah atau halogenating reagen seperti N-bromosuccinimide.
Pembuatan penyejuk
Ia digunakan dalam pengeluaran chlorofluorocarbon, penyejuk R-11 dan trichlorofluoromethane, penyejuk R-12. Penyejuk ini memusnahkan lapisan ozon, sebab itu mereka mencadangkan pemberhentian penggunaannya, menurut cadangan Protokol Montreal.
Penindasan api
Pada permulaan abad ke-20, karbon tetraklorida mula digunakan sebagai alat pemadam kebakaran, berdasarkan satu set sifat kompaun: ia tidak menentu; wapnya lebih berat dari udara; Ia bukan konduktor elektrik dan ia tidak mudah terbakar.
Apabila karbon tetraklorida dipanaskan ia menjadi wap yang berat meliputi produk pembakaran, mengasingkan oksigen di udara dan menyebabkan api dipadamkan. Ia sesuai untuk memerangi kebakaran minyak dan peralatan.
Walau bagaimanapun, pada suhu melebihi 500 ° C karbon tetraklorida boleh bertindak balas dengan air menyebabkan fosgen, sebatian toksik, jadi mesti diberi perhatian kepada pengudaraan semasa digunakan. Di samping itu, ia boleh bertindak balas dengan natrium metalik, mengelakkan penggunaannya dalam kebakaran dengan kehadiran logam ini.
Pembersihan
Karbon tetraklorida telah digunakan dalam cucian kering pakaian dan bahan lain untuk digunakan di rumah. Di samping itu, ia digunakan sebagai degreaser logam industri, sangat baik untuk melarut minyak dan minyak.
Analisis kimia
Ia digunakan untuk pengesanan boron, bromida, klorida, molibdenum, tungsten, vanadium, fosforus dan perak.
Spektroskopi inframerah dan resonans magnetik nuklear
-Ia digunakan sebagai pelarut dalam spektroskopi inframerah, kerana karbon tetraklorida tidak mempunyai penyerapan yang signifikan dalam band> 1600 cm-1.
-Ia digunakan sebagai pelarut dalam resonans magnetik nuklear, kerana ia tidak mengganggu teknik ini kerana ia tidak mempunyai hidrogen (ia adalah aprotik). Tetapi kerana ketoksikannya, dan kerana kuasa pelarutnya rendah, karbon tetraklorida telah digantikan oleh pelarut-pelarut yang deuter..
Pelarut
Ciri-ciri sebatian bukan kutub membolehkan penggunaan karbon tetraklorida sebagai agen pelarut minyak, lemak, lakuer, varnis, lilin, getah dan resin. Ia juga boleh membubarkan yodium.
Kegunaan lain
-Ini adalah komponen penting dalam lampu lava, kerana keterkaitannya dengan karbon tetraklorida menambah berat kepada lilin.
-Digunakan oleh pengumpul setem, kerana ia menunjukkan tanda air pada setem tanpa menyebabkan kerosakan.
-Ia telah digunakan sebagai racun perosak, racun kulat dan penyemburan bijirin untuk menghilangkan serangga.
-Dalam proses pemotongan logam, ia digunakan sebagai pelincir.
-Ia telah digunakan dalam perubatan veterinar sebagai anthelmintik dalam rawatan fasciolasis, yang disebabkan oleh Fasciola hepatica dalam domba.
Ketoksikan
-Karbon tetraklorida boleh diserap melalui saluran pernafasan, pencernaan, mata dan kulit. Pengingesan dan penyedutan adalah sangat berbahaya kerana ia boleh mengakibatkan kerosakan teruk pada otak, hati dan buah pinggang.
-Hubungan dengan kulit menghasilkan kerengsaan dan dalam jangka panjang ia boleh menyebabkan dermatitis. Walaupun bersentuhan dengan mata menyebabkan kerengsaan.
Mekanisme hepatotoksik
Mekanisme utama yang menyebabkan kerosakan hati adalah tekanan oksidatif dan perubahan kalsium homeostasis..
tekanan oksidatif ketidakseimbangan antara pengeluaran spesies oksigen reaktif dan keupayaan badan untuk menghasilkan persekitaran penurunan dalam sel-sel mereka, mengawal proses oksidatif.
Ketidakseimbangan dalam keadaan redoks normal boleh menyebabkan kesan toksik oleh pengeluaran peroksida dan radikal bebas yang merosakkan semua komponen sel.
Karbon tetraklorida dimetabolisme menghasilkan radikal bebas: Cl3C. (trichloromethyl radikal) dan Cl3COO. (trichloromethylperoxide radikal). Radikal bebas ini menghasilkan lipoperoxidation, yang menyebabkan kecederaan pada hati dan juga paru-paru.
Radikal bebas juga menyebabkan pecah membran plasma sel hati. Ini menghasilkan peningkatan kepekatan cytosolic kalsium dan pengurangan dalam mekanisme intraselular penyerapan kalsium.
Peningkatan kalsium intraselular mengaktifkan enzim fosfolipase A2 yang bertindak pada fosfolipid membran, memburukkan pengaruhnya. Di samping itu, terdapat penyusupan neutrofil dan kecederaan hepatoselular. Terdapat penurunan dalam kepekatan selular ATP dan glutation yang menyebabkan ketidakaktifan enzim dan kematian sel.
Kesan toksik dalam sistem buah pinggang dan sistem saraf pusat
Kesan toksik karbon tetraklorida ditunjukkan dalam sistem buah pinggang dengan pengurangan pengeluaran air kencing dan air tubuh. Terutamanya dalam paru-paru dan peningkatan kepekatan sisa metabolik dalam darah. Ini boleh menyebabkan kematian.
Di peringkat sistem saraf pusat, terdapat penglibatan pengaliran aksional impuls saraf.
Kesan pendedahan manusia
Tempoh pendek
Kerengsaan mata; kesan pada hati, buah pinggang dan sistem saraf pusat, boleh mengakibatkan kehilangan kesedaran.
Tempoh lama
Dermatitis dan kemungkinan tindakan karsinogenik.
Interaksi toksik
Terdapat hubungan antara banyak kes-kes mabuk dengan karbon tetraklorida dan penggunaan alkohol. Pengambilan alkohol yang berlebihan menyebabkan kerosakan hati, menghasilkan sirosis hati dalam beberapa kes.
Telah diperhatikan bahawa ketoksikan karbon tetraklorida meningkat dengan barbiturat, kerana ini mempunyai beberapa kesan toksik yang sama.
Sebagai contoh, di peringkat buah pinggang, barbiturat mengurangkan perkumuhan air kencing, tindakan barbiturat ini sama dengan kesan toksik karbon tetraklorida pada fungsi buah pinggang.
Interaksi antara intermolecular
The CCl4 Ia boleh dianggap sebagai tetrahedron hijau. Bagaimanakah ia berinteraksi dengan orang lain??
Sebagai molekul apolar, tanpa momen dipol kekal, ia tidak dapat berinteraksi dengan daya dipole-dipole. Untuk memegang molekul mereka bersama-sama dalam cecair, atom klorin (simpang tetrahedra) mesti berinteraksi dengan satu sama lain dalam beberapa cara; dan mereka berjaya berkat kuasa penyebaran London.
Awan elektron atom Cl bergerak, dan untuk saat-saat ringkas, menghasilkan kawasan elektron yang kaya dan miskin; iaitu, ia menghasilkan polip segera.
Kawasan yang kaya dengan elektron δ- menyebabkan atom Cl dari molekul jiran untuk polarisasi: Clδ-δ+Oleh itu, dua atom Cl boleh diadakan bersama untuk masa yang terhad.
Tetapi, mempunyai berjuta-juta molekul CCl4, interaksi menjadi cukup berkesan untuk membentuk cecair di bawah keadaan normal.
Di samping itu, empat Cl dikaitkan secara kovalen kepada setiap C dengan ketara meningkatkan bilangan interaksi ini; begitu banyak, bahawa ia mendidih pada 76.8ºC, titik mendidih yang tinggi.
Titik mendidih CCl4 ia tidak boleh lebih tinggi kerana tetrahedra adalah agak kecil berbanding sebatian apolar lain (seperti xylene, yang mendidih pada 144ºC).
Rujukan
- Hardinger A. Steven. (2017). Glosari Illustrasi Kimia Organik: Karbon tetraklorida. Diperolehi daripada: chem.ucla.edu
- Semua Siyavula. (s.f.). Angkatan Intermolecular dan Interatomic. Diperolehi daripada: siyavula.com
- Carey F. A. (2006). Kimia Organik (Edisi keenam). Mc Graw Hill.
- Wikipedia. (2018). Karbon tetraklorida. Diperolehi daripada: en.wikipedia.org
- PubChem. (2018). Carbon Tetrachloride. Diperolehi daripada: pubchem.ncbi.nlm.nih.gov
- Buku Kimia. (2017). Karbon tetraklorida. Diperolehi daripada: chemicalbook.com


