Struktur Kimia, Properties dan Kegunaan Manganese Oxide (MnO2)
The mangan oksida (MnO2) Adakah sebatian kimia bukan organik yang terdiri daripada unsur mangan dengan beberapa pengoksidaan +4 dan oksigen di dalam pembentukan oksida ia mempunyai nombor pengoksidaan -2. Ia juga dikenali dengan nama mangan (IV) oksida dan mangan anhidrida.
Ia adalah pepejal dari gelap hingga kopi hitam. Ia bersifat seperti pirolusit mineral, dendrite membentuk hitam dan kristal (perpanjangan bercabang). Ia boleh diperolehi sebagai sisa hitam dalam tindak balas antara etilena dan kalium permanganat selepas pembentukan glycol oleh tindakan pengoksidaan kalium permanganat.

Ia adalah sangat penting dalam industri kaca kerana sifat iaitu agen pengoksidaan, ia menghapuskan hijau daripada sebatian ferus dan menukar ferik.
Indeks
- 1 Struktur kimia
- 2 Hartanah
- 3 Kegunaan
- 3.1 Sebagai pemangkin
- 4 Kesan kesihatan
- 5 Rujukan
Struktur kimia
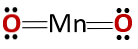
Struktur kimia senyawa itu sesuai dengan anhidrida dan bukannya oksida asas, seperti yang diharapkan kerana ia terdiri daripada logam dan bukan logam.
Kes ini khas disebabkan oleh kelakuan yang diandaikan oleh mangan dalam keadaan pengoksidaan yang berbeza. Oleh itu, untuk keadaan pengoksidaan +2 dan +3 membentuk oksida MnO dan Mn2O3 masing-masing, bahawa apabila bertindak balas dengan air, mereka membentuk hidroksida mangan dan hidroksida mangan.
Walau bagaimanapun, Mn2O3 dalam medium sedikit berasid ia berkelakuan seperti anhidrida. Dengan keadaan pengoksidaan +4, +6 dan +7, MnO2, MnO3 dan MnO4 mereka membentuk asid apabila bertindak balas dengan air.
Dalam medium sedikit berasid MnO2 ia berfungsi seperti oksida asas, jadi ia boleh membentuk hidroksida yang sepadan.

Perlu diingat bahawa dalam hal ini tidak disebutkan sifat amphoterik, yang menurutnya senyawa dapat berperilaku sebagai asid atau sebagai pangkalan. Ini adalah satu kes yang khas untuk tingkah laku Mn.
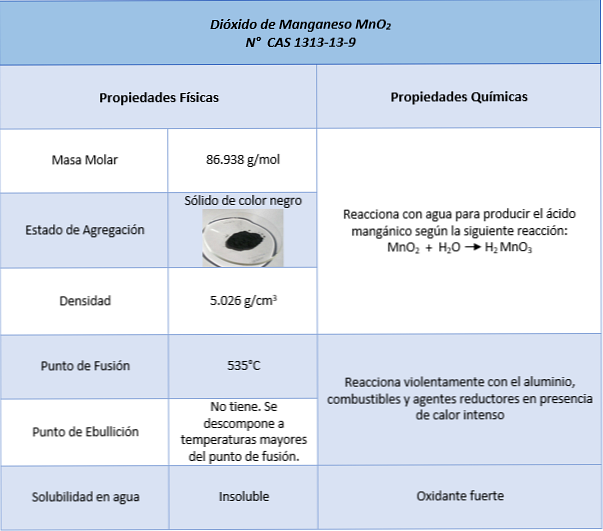
Hartanah
Kegunaan
- Ia digunakan sebagai sumber mangan
- Sebagai oksidan dalam bateri alkali
- Cat untuk kaca, seramik dan porselin.
- Dalam mendapatkan klorin dan iodin.
- Dalam penguraian hidrogen peroksida untuk pembentukan oksigen gas dan air.
- Dalam tindak balas penguraian kalium klorat untuk pengeluaran oksigen gas dan kalium klorida.
- Dilarutkan dalam aseton atau dalam diklorometana, mengoksidakan alkohol utama kepada aldehid dan menengah ke keton.
- Pembuatan bateri alkali.
Sebagai pemangkin
Ini terpakai untuk tindak balas pengurangan oksida, untuk penghapusan sulfida seperti H2S dan kation seperti Fe+2 dan Mn+2 , arsenik dan radio yang terdapat di dalam air bawah tanah yang tercemar oleh jenis sebatian ini.
Pencemaran ini boleh dijana sama ada tidak terkawal lambakan bahan-bahan toksik, dengan membasuh tanah yang tercemar atau kehadiran unsur-unsur kimia pada masa pengambilan air.
The MnO2 Keaslian tinggi yang diperoleh dari pyrolusite yang digunakan sebagai penapis (Filox) adalah cara yang paling berkesan untuk menghapuskan kekotoran kelas ini dari air bawah tanah.
Kesan kesihatan
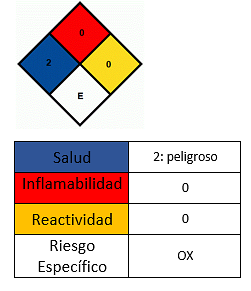
- Elakkan bersentuhan dengan kulit.
- Sekiranya bersentuhan, basuh kawasan yang sepadan.
- Jangan menyedut serbuk.
- Kerengsaan dan kemerahan boleh dilihat pada mata. Basuh dengan banyak air, biarkan air mengalir melalui mata dan panggil bantuan perubatan sekiranya serius.
- Dalam hubungan dengan kerengsaan kulit dan kemerahan diperhatikan. Basuh kawasan yang terjejas dengan banyak air dan sabun.
- Hubungan kulit yang berpanjangan menghilangkan lemak semulajadi anda, memicu dermatitis.
- Penyedutan boleh menyebabkan keadaan seperti flu (asap logam). Keadaan ini dicirikan oleh demam tinggi, menggigil, mulut kering dan tekak, sakit otot dan sakit kepala.
- Ia boleh merengsakan saluran pernafasan dan meningkatkan kejadian jangkitan pernafasan (radang paru-paru). Muntah oleh penyerapan garam mangan tak organik melalui paru-paru tidak mungkin, tetapi keracunan kronik boleh berlaku.
- Pendedahan kronik kepada habuk atau asap mangan dioksida dalam tempoh yang panjang boleh menjejaskan sistem saraf pusat dan merangsang pembangunan yang sama dengan penyakit Parkinson, kesukaran berjalan kaki, kekejangan otot dan perubahan tingkah laku.
- Pengingesan boleh menyebabkan sakit perut dan loya.
- Ia tidak mudah terbakar, tetapi ia membantu menyebarkan bahan api di dalam bahan pijar. Jika dipanaskan ke suhu di atas 535 ° C bahan itu terurai kepada mangan oksida (III) Mn2O3 dan oksigen, yang mudah terbakar dan meningkatkan bahaya kebakaran. Dalam hal ini api harus dipadamkan dengan buih atau karbon dioksida.
- Sekiranya tumpahan, jangan memanipulasi kompaun tanpa perlindungan peribadi yang betul.
- Simpan sebatian dalam bekas yang ketat, di tempat yang sejuk dan kering dan jauh dari bahan yang tidak serasi seperti bahan organik dan bahan mudah terbakar.
- Tempat penyimpanan mesti kering dan tahan lantai terhadap kakisan asid dan dengan saliran yang baik..
- Peralatan perlindungan peribadi harus digunakan, seperti sarung tangan, kacamata keselamatan, topeng penapis anti-wap, debu dan asap.
Rujukan
- B, (2015), Manganese Dioxide, The Royal Society of Chemistry - Dunia kimia, diambil dari chemistryworld.com
- Karal, (2014), Mangneso Dioxide, Lembaran Data Keselamatan, Diperolehi daripada, karal.com.mx
- Guru maya anda (2015-02-25). Sebatian anorganik mangan (kes khas 1) - Pelajaran teoritis), diambil dari, youtube.com
- Dihasilkan, (s.f), Mangan Dioksida, Dipulihkan daripada ecured.cu
- Angarita G, Johnny., (2017), Manganese Dioxide: Teknologi Yang Menakjubkan. Hydrotec, pulih dari hydrotecocr.com
- Fernández, G., (2015), MnO Manganese Dioxide2/ aseton, Kimia Organik, Pulih daripada quimicaorganica.net
- Tronox, (2011), Mangan Dioksida, Lembaran Data Keselamatan, Diperolehi daripada, tronox.com


