Formula Natrium Oksida (Na2O), Hartanah, Risiko
The natrium oksida adalah sebatian organik Na formula2O. Seperti semua oksida logam alkali, mempunyai antifluorite yang sama (sama fluorspar, CaF2, tetapi dengan kation dan anion terbalik) yang sepadan dengan padu muka struktur kristal berpusat. (Natrium: disodium oksida, 1993-2016).
Ia boleh dikatakan bahawa natrium oksida adalah anhidrida natrium hidroksida, kerana ia bertindak balas dengan air untuk membentuk dua mol sebatian ini dengan cara berikut:
Na2O + H2O → 2NaOH
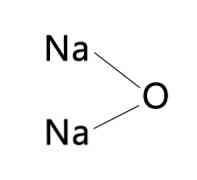
Secara umumnya, nama KNaO boleh didapati, merujuk kepada natrium oksida atau kalium oksida. Ini kerana kedua-dua oksida mempunyai sifat yang sama dari segi warna dan halaju pengembangan dan kontraksi.
Sumber-sumber natrium oksida yang sering tidak boleh digunakan termasuk kesan potasium oksida, contohnya dalam feldspars (angka 2), yang merupakan sumber utama natrium dalam enamel tertentu (Britt, 2007).

Indeks
- 1 Sifat fizikal dan kimia
- 2 Reaktiviti dan bahaya
- 3 Kegunaan
- 4 Rujukan
Sifat fizikal dan kimia
Natrium oksida adalah pepejal kristal putih (angka 3). Ia mempunyai berat molekul 61.98 g / mol, mempunyai kepadatan 2.27 g / ml dan titik lebur 1275 ° C.
kompaun itu mempunyai titik didih 1950 ° C yang mula mengurai natrium peroksida dan logam natrium, bagaimanapun, hartanah menarik ialah oksida natrium mula menghaluskan pada 1100 ° C (Pusat Kebangsaan bagi Maklumat Bioteknologi, SF ).

Reacts violently dengan air dan alkohol untuk membentuk natrium hidroksida. Natrium oksida, Na2Atau, ia boleh menyerap hidrogen (H2), untuk membentuk natrium hidrida (NaH) dan natrium hidroksida (NaOH), yang mempunyai potensi untuk mencari aplikasinya kepada penyimpanan hidrogen yang boleh terbalik.
Reaktiviti dan bahaya
Sodium oxide adalah sebatian yang tidak mudah terbakar, tetapi boleh bertindak balas dengan ganas dengan asid dan air. Ia juga boleh meningkatkan pembakaran bahan-bahan lain. Ia dikelaskan sebagai menghakis dan boleh membakar kulit dan mata (Royal Society of Chemistry, 2015).
Penyelesaian dalam air adalah asas yang kuat, kerana ia bertindak balas dengan ganas dengan asid yang menghakis. Apabila bertindak balas dengan ganas dengan air, natrium hidroksida dihasilkan, menyerang banyak logam dengan kehadiran air.
Bahan ini juga mengakis ke saluran pernafasan dan pengingesan. Penyedutan aerosol boleh menyebabkan edema pulmonari (Institut Keselamatan dan Kesihatan Pekerjaan Negara, 2014).
Sekiranya sedutan, orang yang terpengaruh perlu dipindahkan ke tempat yang sejuk. Sekiranya mangsa tidak bernafas, pernafasan buatan perlu diberikan. Kemudian pergi atau berjumpa dengan doktor secepat mungkin.
Sekiranya terdapat sentuhan kulit, pakaian dan kasut yang tercemar hendaklah dikeluarkan serta-merta dan dibasuh dengan banyak air.
Sekiranya bersentuhan dengan mata, bilas dengan banyak air selama sekurang-kurangnya 15 minit dan dapatkan nasihat doktor. Sekiranya anda menelan, jangan berfikir tentang muntah, tetapi bilas mulut dengan air dan dapatkan nasihat doktor.
Tanda-tanda yang paling penting dan kesan boleh: kekejangan, keradangan dan edema larinks dan bronkus, pneumonitis, edema pulmonari, pedih, batuk, berdehit, laryngitis dan sesak nafas (Sodium oksida (Na2O) (cas 1313- 59-3) MSDS, 2010-2017).
Gejala-gejala edema paru-paru sering tidak diketahui sehingga selepas beberapa jam dan diperparah oleh penuaan fizikal. Oleh itu, rehat dan pemerhatian perubatan adalah penting.
Natrium oksida perlu disimpan di tempat yang kering dan dipisahkan dari asid kuat. Memandangkan sebatian itu bertindak balas terhadap air, sekiranya berlaku kebakaran, pemadam atau penyiram berasaskan air tidak boleh digunakan. Adalah disyorkan untuk menggunakan serbuk kering atau pasir.
Kegunaan
Penggunaan utama natrium oksida adalah dalam pembuatan kaca. Ia digunakan dalam seramik dan kacamata, walaupun tidak dalam bentuk mentah. Sodium oxide umumnya membentuk kira-kira 15% daripada komposisi kimia kaca.
Ia mengurangkan suhu di mana silikon dioksida cair (komposisi kaca pada 70%), menghasilkan lebih murah dan lebih efisien untuk menghasilkan kaca kerana ia memerlukan perbelanjaan tenaga yang lebih rendah di bahagian pengeluar (George Sumner, sf ).
Kaca natrium-kapur adalah bentuk yang paling biasa kaca yang dihasilkan, yang terdiri kira-kira 70% silika (silikon dioksida), 15% soda (natrium oksida) dan 9% kapur (kalsium oksida), dengan jumlah yang lebih kecil sebatian lain.
Natrium oksida berfungsi sebagai fluks untuk menurunkan suhu di mana silika cair, dan kapur bertindak sebagai penstabil untuk silika. Gelas sodium-limau adalah murah, stabil secara kimia, agak sukar, dan sangat boleh digunakan, kerana ia mampu melembutkan beberapa kali jika perlu.
Kualitas ini menjadikannya sesuai untuk pembuatan pelbagai jenis produk kaca, termasuk mentol lampu, gelas, botol dan benda seni.
Sebaliknya, natrium oksida dan silika mengandungi kristal air, juga dikenali sebagai natrium silikat atau gelas air, yang membentuk pepejal vitreous dengan sifat sangat berguna yang larut dalam air.
Gelas air dijual sebagai benjolan pepejal atau serbuk, atau sebagai cecair yang jelas dan manis. Ia digunakan sebagai sumber yang mudah untuk natrium untuk banyak produk industri sebagai pembina dalam detergen dobi, sebagai pengikat dan pelekat, sebagai flocculant dalam loji rawatan air dan dalam banyak aplikasi lain (Encyclopaedia Britannica, 2017).
Sebatian oksida tidak membawa kepada elektrik. Walau bagaimanapun, oksida terstruktur tertentu perovskite adalah konduktor elektronik untuk aplikasi dalam katod sel bahan bakar oksida pepejal dan sistem penjanaan oksigen (Elemen Amerika, 1998-2017).
Rujukan
- Institut Keselamatan dan Kesihatan Pekerjaan Negara. (2014, 1 Julai). CDC SODIUM OXIDE. Pulih daripada cdc.
- Elemen Amerika. (1998-2017). Natrium oksida. Pulih dari americanelements.com.
- Britt, J. (2007). Panduan Lengkap untuk Glazes Kebakaran Tinggi. New York: Lark Books.
- Ensiklopedia britannica. (2017). Sebatian kimia natrium oksida. Pulih dari britannica.com.
- George Sumner, D. J. (s.f.). Apakah kegunaan natrium oksida? Pulih daripada quora.com.
- Pusat Kebangsaan Maklumat Bioteknologi. (S.F.). Pangkalan Data Kompaun PubChem; CID = 73971. Diambil dari pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Natrium oksida. Diperolehi daripada chemspider.com.
- Ruitao Wang, T. K. (2006). Reaksi hidrogen dengan natrium oksida: Sistem hidrogenasi / dehidrogenasi boleh balik. Jurnal Sumber Kuasa, Jilid 155, Isu 2, 167-171. sciencedirect.com.
- Sodium oxide (Na2O) (cas 1313-59-3) MSDS. (2010-2017). Diperolehi daripada guidechem: guidechem.com.
- Natrium: natrium oksida. (1993-2016). Diperolehi daripada webelements: webelements.com.


