Asas pewarisan, teknik dan kegunaan spora
The pewarnaan spora adalah metodologi yang digunakan untuk mewarnai struktur rintangan yang membentuk beberapa genera bakteria apabila mereka berada dalam keadaan tidak baik; struktur ini sesuai dengan cara hidup.
Terdapat banyak genera yang membentuk spora; Walau bagaimanapun, yang utama adalah Bacillus dan Clostridium. Genera ini dianggap lebih relevan kerana mereka mempunyai spesies patogen untuk manusia.
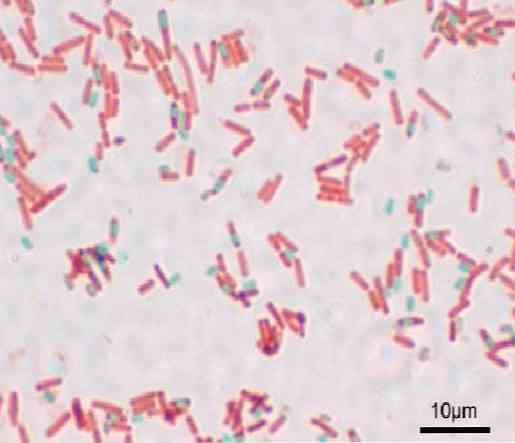
Setiap bacillus boleh menimbulkan spora. Pada masa pencelupan penyediaan, spora boleh didapati di dalam bacillus (endospore) atau di luarnya (exospore). Dengan teknik pewarnaan konvensional untuk bakteria - seperti noda Gram - spora masih tidak berwarna.
Pada masa ini, terdapat beberapa metodologi pewarna yang boleh menyebarkan struktur tebal spora untuk mewarna. Metodologi ini sangat berbeza; Di antara ini kita dapat menyebut teknik Dorner, Möeller noda dan metodologi Shaeffer-Fulton, yang juga dikenali sebagai Wirtz-Conklin..
Daripada semua teknik yang disebutkan, metodologi Shaeffer-Fulton adalah yang paling banyak digunakan dalam makmal rutin. Ia berhutang namanya kepada dua ahli mikrobiologi yang mencipta pewarnaan pada tahun 1930: Alicia Shaeffer dan MacDonald Fulton. Walau bagaimanapun, kadangkala teknik ini dipanggil Wirtz-Conklin sebagai penghormatan kepada dua ahli bakteriologi pada tahun 1900-an.
Indeks
- 1 Yayasan
- 2 teknik spora pewarna
- 2.1 Teknik Dorner
- 2.2 Modified Dorner technique
- 2.3 Teknik Shaeffer-Fulton atau Wirtz-Conklin
- 2.4 teknik Möeller
- 2.5 Modified Möeller teknik tanpa haba
- 3 Kegunaan
- 3.1 Contoh
- 4 Rujukan
Yayasan
Spora tidak noda dengan pewarna konvensional kerana ia mempunyai dinding yang sangat tebal. Komposisi kompleks spora menghalang kemasukan kebanyakan pewarna.
Sekiranya spora dipelajari dari luar ke bahagian dalam, lapisan berikut diperhatikan: pertama, exosporium, yang merupakan lapisan luar nipis yang terbentuk oleh glikoprotein..
Kemudian datang kutikula, yang memberikan ketahanan terhadap suhu tinggi, diikuti oleh korteks yang terdiri dari peptidoglycan. Kemudian terdapat dinding pangkalan yang melindungi protoplas.
Spora adalah struktur dehidrasi yang mengandungi kalsium 15% dan asid dipicolinic. Oleh itu, kebanyakan teknik pewarnaan spora adalah berdasarkan penggunaan haba supaya pewarna boleh menembusi struktur tebal.
Apabila spora dicelup, ia tidak boleh menghilangkan pewarna ini. Dalam teknik Shaeffer-Fulton, hijau malachite memasuki sel-sel vegetatif dan, selepas penggunaan haba, menembusi endospora dan juga exospores.
Apabila mencuci dengan air, pewarna dikeluarkan dari sel vegetatif. Ini berlaku kerana pewarna malachite hijau sedikit asas, jadi ia mengikat lemah ke sel vegetatif.
Sebaliknya, ia tidak boleh keluar dari spora dan akhirnya bacillus dengan safranin berbeza. Yayasan ini sah untuk seluruh teknik, di mana sesuatu yang serupa berlaku.
Teknik pewarna spora
Untuk membuat spora mengotorkan, anda mesti mempunyai budaya tulen tegasan suspek yang anda mahu belajar.
Budaya ini tertakluk kepada suhu yang melampau selama 24 jam untuk merangsang mikroorganisma untuk sporulate. Untuk ini, budaya boleh diletakkan dalam ketuhar pada suhu 44 ° C atau dalam peti sejuk (8 ° C) selama 24 atau 48 jam.
Jika terlalu banyak masa yang tersisa pada suhu yang disebutkan, hanya exospores sahaja yang akan diperhatikan, kerana semua endospora akan meninggalkan bacillus.
Pada akhir masa, beberapa titis penyelesaian fisiologi steril perlu diletakkan pada slaid bersih. Kemudian sebilangan kecil tanaman diambil dan penyebaran yang baik dibuat.
Selepas itu dibiarkan kering, ia tetap panas dan ia ternoda dengan beberapa teknik yang dijelaskan di bawah:
Teknik Dorner
1- Sediakan dalam tiub ujian penggantungan tertumpu mikroorganisma yang tercatat dalam air suling dan tambah jumlah yang sama ditapis Kinyoun phenolic fuchsin.
2 Letakkan tiub di dalam tab mandi dengan air mendidih selama 5 hingga 10 minit.
3- Pada slaid bersih, campurkan setitik penggantungan sebelumnya dengan larutan 10% larutan berair nigrosin, direbus dan ditapis.
4- Perluas dan kering dengan cepat dengan haba yang lembut.
5- Menguji dengan tujuan 100X (rendaman).
Spora adalah merah dan sel bakteria kelihatan hampir tidak berwarna melawan latar belakang kelabu gelap.
Teknik Dorner yang diubahsuai
1- Penggantungan mikroorganisma tersusun tersebar di atas gelangsar dan tetap panas.
2- Sampel ditutup dengan jalur kertas penapis yang ditambahkan fuchsin asid fenik. Pewarna dipanaskan selama 5 hingga 7 minit dengan api pembakar Bunsen sehingga pembebasan wap dihasilkan. Kemudian kertas itu dikeluarkan.
- Basuh penyediaan dengan air dan kemudian kering dengan kertas penyerap.
4- Tutup smear dengan filem tipis 10% nigrosin, menggunakan slaid kedua untuk menyebarkan nigrosin atau jarum.
Pewarnaan yang diambil oleh spora dan bakteria adalah sama seperti yang diterangkan dalam seni terdahulu.
Teknik Shaeffer-Fulton atau Wirtz-Conklin
1- Membuat penyebaran tipis dengan penggantungan mikroorganisma terurai pada slaid dan membaikinya ke panas.
2 Tutup slaid dengan larutan berair 5% malachite hijau (kertas penyaring boleh diletakkan di atas helaian).
3- Panas pada api pembakar Bunsen untuk menyebabkan wap melepaskan dan mengeluarkan api. Ulangi operasi selama 6 hingga 10 minit. Jika semasa prosedur larutan hijau malachite menguap terlalu banyak, lebih banyak boleh ditambah.
4- Keluarkan kertas penapis (jika ia diletakkan) dan basuh dengan air.
5- Tutup slaid dengan 0.5% safranin berair selama 30 saat (beberapa varian teknik menggunakan 0.1% safranin berair dan biarkan selama 3 minit).
Dengan teknik ini, spora berwarna hijau dan bacilli berwarna merah.
Ia mempunyai kelemahan yang endospores budaya muda tidak noda dengan baik, kerana mereka kelihatan sangat jelas atau tidak berwarna. Untuk mengelakkan ini, disyorkan untuk menggunakan budaya 48 jam pengeraman.
Teknik Möeller
1- Melindungi smear dengan kloroform selama 2 minit.
2- Membuang kloroform.
3- Tutup dengan 5% asid kromik selama 5 minit.
- Basuh dengan air sulingan
5- Lembaran ditutup dengan kap minyak fuchsin-phenolic dan terdedah kepada api pembakar Bunsen sehingga pelepasan wap; maka ia dikeluarkan dari api selama beberapa saat. Operasi diulangi sehingga mencapai 10 minit.
- Basuh dengan air.
- Gunakan etanol berasid (alkohol hidroklorik) untuk menyerupai warna. Ia dibiarkan selama 20 atau 30 saat.
8. Basuh dengan air sulingan.
9 - Mengimbangi penutup lembaran dengan metilena biru selama 5 minit.
10 - Basuh dengan air sulingan.
11 - Ia dibiarkan kering dan sampel diambil di bawah mikroskop.
Spora melihat bacilli merah dan biru. Adalah penting untuk tidak menyedut wap, kerana ia adalah toksik dan dalam jangka panjang ia boleh menjadi karsinogenik.
Modifikasi teknik Möeller tanpa haba
Pada tahun 2007, Hayama dan rakan-rakannya membuat modifikasi teknik Möeller. Mereka mengeluarkan langkah pemanasan pewarna dan menggantikannya dengan penambahan 2 titisan daripada surfaktan Tergitol 7 untuk setiap 10 ml larutan carbolic fuchsin-fenolik. Keputusan yang sama diperolehi.
Kegunaan
Pewarna spora menyediakan maklumat yang sangat berharga dan bermanfaat untuk mengenal pasti patogen, kerana kehadirannya yang sama, bentuknya, lokasi dalam bacillus dan keupayaan untuk mengubah bentuk sel vegetatif atau tidak, adalah data yang boleh membimbing spesies terlibat dalam jantina tertentu.
Dalam konteks ini, adalah sepatutnya menyebut bahawa spora boleh bulat atau lekuk, mereka boleh terletak di tengah atau juga dalam posisi paracentral, subterminal atau terminal.
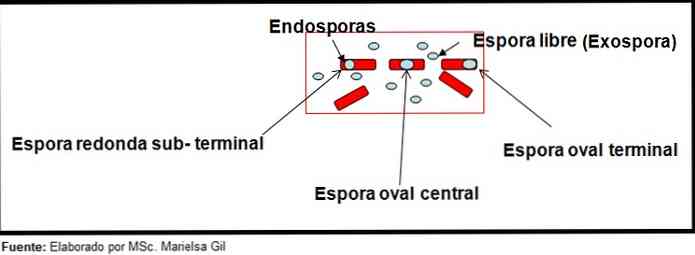
Contohnya
- Clostridium difficile membentuk spora bujur dalam kedudukan terminal yang menyerang bacillus.
- Spora daripada Clostridium tertium Ia bujur, tidak ubah bentuk bacillus dan terletak di paras terminal.
- Endospore of Clostridium tetani ia adalah terminal dan menyerang bacillus, memberikan penampilan drum.
- Spora Clostridium botulinum, C. histolyticum, C. novy dan C. septicum mereka adalah lekuk bulat atau subterminal dan ubah bentuk bacillus.
- Endospore of Clostridium sordelli ia terletak di kedudukan tengah, dengan sedikit ubah bentuk.

Rujukan
- Petua M, Oana K, Kozakai T, Umeda S, Fujimoto J, Ota H, Kawakami Y. Cadangan teknik mudah untuk mengotorkan spora bakteria tanpa menggunakan pengubahsuaian haba yang berjaya dalam kaedah Moeller. Eur J Med Res. 2007; 16 12 (8): 356-9.
- Penyumbang Wikipedia. Moeller noda. Wikipedia, Ensiklopedia Percuma. 3 November, 2018, 03:28 UTC. Boleh didapati di: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011). Manual Makmal Teknik Mikrobiologi. Akademi Mikrobiologi Sains Asas. Institut Politeknik Kebangsaan.
- "Endospora." Wikipedia, ensiklopedia percuma. 25 Feb 2018, 10:20 UTC. 10 Jan 2019, 02:42: en.wikipedia.org
- Silva L, Silva C, Fernández N, Bueno C, Torres J, Rico M, Macías J dan kolaborator. (2006). Pekerja Buruh Komuniti Otonomi Extremadura. Agenda khusus Jilid IV. MAD Editorial. Seville-Sepanyol, ms 211-212.
- Silva M, García M, Corrales J, Ponce E. (2006). Juruteknik makmal pakar, Perkhidmatan Kesihatan Galician (SERGAS). Perkara perkara tertentu 2. MAD Editorial. Seville-Sepanyol, ms 79-80.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnosis mikrobiologi. (Edisi ke-5). Argentina, Editorial Panamericana S.A..
- Forbes B, Sahm D, Weissfeld A. 2009. Diagnosis mikrobiologi Bailey & Scott. 12 ed. Argentina Panamericana S.A Editorial


