Ciri-ciri Hartanah, Struktur, Kegunaan dan Risiko Tin Chloride (SnCl2)
The tin klorida (II) atau stannous klorida, formula kimia SnCl2, adalah sebatian pepejal kristal putih, produk tindak balas timah dan larutan asid hidroklorik tertumpu: Sn (s) + 2HCl (conc) => SnCl2(aq) + H2(g) Proses sintesisnya (penyediaan) terdiri daripada menambahkan kepingan timah untuk bertindak balas dengan asid.
Selepas menambah kepingan timah, ia terus menjalankan dehidrasi dan penghabluran sehingga garam tak organik diperolehi. Dalam sebatian ini, timah telah kehilangan dua elektron dari shell valensinya untuk membentuk ikatan dengan atom klorin.
Ini dapat difahami dengan lebih baik jika seseorang menganggap konfigurasi valensi timah (5s25px2pdan0pz0), di mana pasangan elektron menduduki p orbitx diberikan kepada proton H+, untuk membentuk molekul hidrogen diatomik. Iaitu, ini adalah tindak balas redoks jenis.
Indeks
- 1 Sifat fizikal dan kimia
- 1.1 Konfigurasi Valencia
- 1.2 Reaktiviti
- 1.3 Aktiviti reduksi
- 2 Struktur kimia
- 3 Kegunaan
- 4 Risiko
- 5 Rujukan
Sifat fizikal dan kimia
Pautan SnCl2 Adakah mereka ionik atau kovalen? Ciri-ciri fizikal timah (II) klorida mengesahkan pilihan pertama. Titik lebur dan didih untuk sebatian ini adalah 247 ° C dan 623 ° C, menunjukkan interaksi antara intermolecular lemah, fakta umum untuk sebatian kovalen.
Kristalnya berwarna putih, yang diterjemahkan ke dalam penyerapan nol dalam spektrum yang kelihatan.
Konfigurasi Valencia
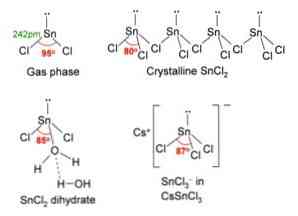
Dalam imej di atas, di sudut kiri atas, molekul SnCl yang terisolasi digambarkan2.
Geometri molekul harus datar kerana hibridisasi atom pusat adalah sp2 (3 sp orbital2 dan p tulen orbit untuk membentuk ikatan kovalen), tetapi pasangan elektron bebas memenuhi isipadu dan menolak atom klorin ke bawah, memberikan molekul geometri sudut.
Dalam fasa gas, sebatian ini terpencil, jadi ia tidak berinteraksi dengan molekul lain.
Sebagai kehilangan sepasang elektron dalam orbit px, timah berubah menjadi ion Sn2+ dan konfigurasi elektronik yang dihasilkan adalah 5s25px0pdan0pz0, dengan semua orbital pnya tersedia untuk menerima pautan dari spesies lain.
Cl ions- menyelaras dengan Sn2+ untuk menimbulkan tin klorida. Konfigurasi elektronik timah dalam garam ini adalah 5s25px2pdan2pz0, dapat menerima sepasang elektron lain dalam orbit bebas pz.
Sebagai contoh, anda boleh menerima ClI yang lain-, membentuk kompleks geometri satah trigonal (piramid dengan asas segi tiga) dan dikenakan secara negatif [SnCl3]-.
Reaktiviti
The SnCl2 mempunyai kereaktifan dan kecenderungan yang tinggi untuk bertindak seperti asid Lewis (reseptor elektron) untuk menyelesaikan oktet valensnya.
Sama seperti menerima Clion-, begitu juga air, yang "melembapkan" atom timah terikat kepada molekul air terus ke timah, dan yang kedua molekul air interaksi bentuk ikatan hidrogen dengan yang pertama.
Hasilnya ialah SnCl2 ia tidak tulen, tetapi diselaraskan dengan air dalam garam yang dihidratkan: SnCl2· 2H2O.
The SnCl2 Ia sangat larut dalam air dan dalam pelarut kutub, kerana ia adalah sebatian polar. Walau bagaimanapun, kelarutan dalam air, kurang daripada berat badannya, mengaktifkan reaksi hidrolisis (pecah molekul air) untuk menghasilkan garam asas dan tidak larut:
SnCl2(aq) + H2O (l) <=> Sn (OH) Cl (s) + HCl (aq)
Arahan berganda menandakan bahawa keseimbangan ditubuhkan, digemari ke kiri (ke arah reaktan) jika peningkatan kepekatan HCl. Untuk ini, penyelesaian SnCl2 digunakan mempunyai pH asid, untuk mengelakkan pemendakan produk garam hidrolisis yang tidak diingini.
Aktiviti pengurangan
Bertindak balas dengan oksigen di udara untuk membentuk timah (IV) klorida atau stannik klorida:
6 SnCl2(aq) + O2(g) + 2H2O (l) => 2SnCl4(aq) + 4Sn (OH) Cl (s)
Dalam reaksi ini timah teroksidasi membentuk ikatan dengan atom oksigen elektronegatif dan meningkatkan bilangan ikatannya dengan atom klorin.
Secara umum, atom halogen elektronegatif (F, Cl, Br dan saya) menstabilkan pautan daripada sebatian Sn (IV) dan ini menjelaskan mengapa SnCl2 ia adalah ejen pengurangan.
Apabila ia mengoksidasi dan kehilangan semua elektron valensnya, Sn4+ ia kekal dengan konfigurasi 5s05px0pdan0pz0, menjadi sepasang elektron dalam orbit 5s yang paling sukar untuk "dirampas".
Struktur kimia
The SnCl2 membentangkan struktur kristal jenis ortorombik, sama dengan baris gergaji, di mana hujung gigi adalah klorida.
Setiap baris adalah rantai SnCl3 membentuk jambatan Cl dengan atom Sn lain (Cl-Sn (Cl)2-Cl- ···), seperti yang dapat dilihat dalam imej di atas. Dua rantaian, yang dikaitkan dengan interaksi lemah jenis Sn-Cl, membentuk satu lapisan susunan, yang ditapis pada lapisan lain, dan seterusnya sehingga pepejal kristal ditakrifkan.
5s pasangan elektron percuma2 menyebabkan penyimpangan dalam struktur kerana ia menduduki jumlah (jumlah awan elektronik).
The Sn boleh mempunyai nombor penyelarasan yang sama dengan sembilan, yang sama dengan mempunyai sembilan jiran, melukis prisma trigonal dengan ini terletak di pusat angka geometrik dan Cl di simpang, di samping Cl lain yang terletak di setiap muka prisma persegi.
Ini adalah yang paling mudah dilihat apabila mempertimbangkan rangkaian mana Sn (kawasan kelabu gelap) menunjuk ke atas, dan tiga Cl yang dikaitkan dengan bentuk segi tiga ini lantai, manakala tiga atas Cl membentuk bumbung segi tiga.
Kegunaan
Dalam sintesis organik ia digunakan sebagai agen pengurangan untuk sebatian nitro aromatik (Ar-NO2 à Ar-NH2). Oleh kerana struktur kimianya adalah laminar, ia dapat digunakan dalam dunia pemangkin tindakbalas organik, di samping menjadi calon yang berpotensi untuk menyokong pemangkin.
Harta pengurangannya digunakan untuk menentukan kehadiran sebatian emas, untuk memakai kacamata dengan cermin perak dan bertindak sebagai antioksidan.
Juga, dalam piramid trigonal geometri molekulnya (: SnX3- M+) digunakan sebagai asas Lewis untuk sintesis sebilangan besar sebatian (seperti kompleks kluster Pt)3Sn8Cl20, di mana pasangan bebas elektron diselaraskan dengan asid Lewis).
Risiko
The SnCl2 Ia boleh merosakkan sel darah putih. Ia menghakis, merengsa, karsinogenik, dan mempunyai kesan negatif yang tinggi terhadap spesies yang mendiami ekosistem laut.
Ia boleh diuraikan pada suhu tinggi, melepaskan gas klorin yang berbahaya. Dalam hubungan dengan agen pengoksidaan, ia mencetuskan tindak balas yang meletup.
Rujukan
- Shiver & Atkins. (2008). Kimia anorganik In Unsur kumpulan 14 (edisi keempat, halaman 329). Mc Graw Hill.
- ChemicalBook. (2017). Diambil pada 21 Mac, 2018, dari ChemicalBook: chemicalbook.com
- PubChem. (2018). Tin Chloride. Diperoleh pada 21 Mac, 2018, dari PubChem: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2017). Tin (II) klorida. Diperoleh pada 21 Mac, 2018, dari Wikipedia: en.wikipedia.org
- E. G. Rochow, E. W. (1975). Kimia Germanium: Tin dan Lead (ed pertama). p-82.83. Pergamom Press.
- F. Hulliger. (1976). Kimia Struktur Fasa Layer-Type. P-120,121. D. Reidel Publishing Company.



