Undang-undang Raoult Apa Yang Terdiri, Penyimpangan Positif dan Negatif
The Undang-undang Raoult telah dicadangkan oleh ahli kimia Perancis François-Marie Raoult pada tahun 1887, dan berfungsi untuk menjelaskan kelakuan tekanan wap penyelesaian dua bahan larutan (biasanya ideal) bergantung pada tekanan wap separa setiap komponen yang hadir dalam.
Terdapat undang-undang kimia yang digunakan untuk menggambarkan kelakuan bahan dalam keadaan yang berbeza dan menjelaskan fenomena yang mereka terlibat, menggunakan model matematik terbukti secara saintifik. Undang-undang Raoult adalah salah satu daripada ini.

Menggunakan penjelasan berdasarkan interaksi antara molekul gas (atau cecair) untuk meramal kelakuan tekanan wap, undang-undang ini digunakan untuk mengkaji penyelesaian yang tidak sesuai atau nyata, dengan syarat pekali-pekali yang diperlukan dianggap memperbaiki model matematik dan menyesuaikannya dengan keadaan yang tidak sesuai.
Indeks
- 1 Apa itu terdiri daripada??
- 2 Penyimpangan positif dan negatif
- 2.1 Penyimpangan positif
- 2.2 Penyimpangan negatif
- 3 Contoh
- 3.1 Asas campuran
- 3.2 Campuran perduaan dengan larutan tidak menentu
- 4 Rujukan
Apa itu terdiri daripada??
Undang-undang Raoult berdasarkan pada anggapan bahawa penyelesaian yang terlibat berperilaku dengan cara yang ideal: ini terjadi karena hukum ini didasarkan pada gagasan bahwa kekuatan intermolecular antara molekul yang berbeda sama dengan yang diantara molekul yang sama (yang ia tidak begitu berjaya dalam realiti).
Sebenarnya, pendekatan yang lebih dekat adalah ke arah idealisasi, semakin banyak peluang yang diperlukan untuk mematuhi ciri-ciri yang dicadangkan oleh undang-undang ini..
Undang-undang ini menyentuh tekanan wap penyelesaian dengan larutan tidak berubah-ubah, menyatakan bahawa ia akan sama dengan tekanan wap larutan tulen pada suhu itu, didarabkan oleh pecahan molarnya. Ini dinyatakan dalam istilah matematik untuk satu komponen dengan cara berikut:
Pi = Pºi . Xi
Dalam ungkapan ini Pi sama dengan tekanan wap separa komponen i dalam campuran gas, Pºi adalah tekanan wap komponen tulen i, dan Xi adalah pecahan mol bagi komponen i dalam campuran.
Dengan cara yang sama, apabila anda mempunyai beberapa komponen dalam penyelesaian dan mereka telah mencapai keadaan keseimbangan, anda boleh mengira tekanan wap keseluruhan penyelesaian dengan menggabungkan undang-undang Raoult dengan Dalton:
P = PºAXA + PºBXB + PºCXc...
Selain itu, dalam penyelesaian yang terdapat hanya satu larut dan pelarut, undang-undang boleh dirumuskan seperti yang ditunjukkan di bawah:
PA = (1-XB) x PºA
Penyimpangan positif dan negatif
Penyelesaian yang boleh dikaji dengan undang-undang ini biasanya harus bersikap ideal, kerana interaksi antara molekul mereka adalah kecil dan membenarkan sifat yang sama diasumsikan sepanjang larutan tanpa pengecualian..
Walau bagaimanapun, penyelesaian ideal hampir tidak wujud dalam realiti, jadi dua koefisien mesti dimasukkan ke dalam pengiraan yang mewakili interaksi antara intermolecular. Ini adalah koefisien fugacity dan pekali aktiviti.
Dalam pengertian ini, penyimpangan berkenaan dengan undang-undang Raoult didefinisikan sebagai positif atau negatif, bergantung kepada keputusan yang diperoleh pada masa itu.
Penyimpangan positif
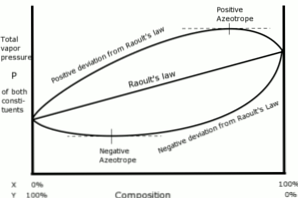
Penyimpangan positif berkenaan dengan undang-undang Raoult berlaku apabila tekanan wap larutan lebih besar daripada yang dikira dengan undang-undang Raoult.
Ini berlaku apabila daya perpaduan antara molekul yang sama lebih besar daripada daya yang sama antara molekul yang berbeza. Dalam kes ini, kedua-dua komponen menguap lebih mudah.
Penyimpangan ini dilihat dalam lengkung tekanan wap sebagai titik maksimum dalam komposisi tertentu, membentuk azeotrope positif.
Azeotrope adalah campuran cecair dari dua atau lebih senyawa kimia yang berperilaku seolah-olah ia dibentuk oleh satu komponen dan yang menguap tanpa mengubah komposisi.
Penyimpangan negatif
Penyimpangan negatif dari undang-undang Raoult berlaku apabila tekanan wap campuran lebih rendah daripada yang dijangkakan selepas pengiraan dengan undang-undang.
Penyimpangan ini muncul apabila daya perpaduan antara molekul campuran lebih besar daripada purata daya antara zarah-zarah cecair dalam keadaan tulen mereka.
Jenis penyelewengan ini menjana pengekalan setiap komponen dalam keadaan cairnya oleh daya tarikan yang lebih besar daripada bahan dalam keadaan tulennya, supaya tekanan wap separa sistem dikurangkan.
Azeotrops negatif dalam lengkung tekanan wap mewakili titik minimum, dan menunjukkan pertalian antara dua atau lebih komponen yang terlibat dalam campuran.
Contohnya
Undang-undang Raoult biasanya digunakan untuk mengira tekanan penyelesaian berdasarkan kekuatan intermolecularnya, membandingkan nilai-nilai yang dikira dengan nilai-nilai sebenar untuk menyimpulkan jika terdapat sebarang penyelewengan dan jika ini harus positif atau negatif. Berikut adalah dua contoh penggunaan undang-undang Raoult:
Campuran asas
Campuran berikut, yang terdiri daripada propana dan butana, mewakili anggaran tekanan wap, dan kita boleh mengandaikan bahawa kedua-dua komponen berada dalam perkadaran yang sama di dalamnya (50-50), pada suhu 40 ° C:
Xpropana = 0.5
Pºpropana = 1352.1 kPa
Xbutana = 0.5
Pºbutana = 377.6 kPa
Ia dikira dengan undang-undang Raoult:
Pcampuran = (0.5 x 377.6 kPa) + (0.5 x 1352.1 kPa)
Jadi:
Pcampuran = 864.8 kPa
Campuran perdu dengan larutan tidak menentu
Kadang-kadang ia berlaku bahawa larutan campuran tidak berubah-ubah, jadi undang-undang digunakan untuk memahami kelakuan tekanan wap.
Memandangkan campuran air dan gula dalam kadar 95% dan 5%, masing-masing, dan di bawah keadaan suhu biasa:
Xair = 0.95
Pºair = 2.34 kPa
Xgula = 0.05
Pºgula = 0 kPa
Ia dikira dengan undang-undang Raoult:
Pcampuran = (0.95 x 2.34 kPa) + (0.05 x 0 kPa)
Jadi:
Pcampuran = 2.22 kPa
Jelas sekali terdapat tekanan tekanan wap air akibat kesan daya intermolecular.
Rujukan
- Anne Marie Helmenstine, P. (s.f.). Definisi Undang-undang Raoult. Diambil dari thoughtco.com
- ChemGuide. (s.f.). Undang-undang Raoult dan Solusi Non-Volatile. Diperolehi daripada chemguide.co.uk
- FreeTexts. (s.f.). Undang-undang Raoult dan Campuran Ideal Cecair. Diperolehi daripada chem.libretexts.org
- Neutrium. (s.f.). Undang-undang Raoult. Diperolehi daripada neutrium.net
- Wikipedia. (s.f.). Undang-undang Raoult. Diambil dari en.wikipedia.org


