Etil ether sifat, struktur, mendapatkan, kegunaan
The etil eter, juga dikenali sebagai dietil eter, adalah sebatian organik yang formula kimianya adalah C4H10O. Ia dicirikan oleh menjadi cecair yang tidak berwarna dan tidak menentu, dan oleh itu, botol-botolnya mesti ditutup sebagai hermetically mungkin.
Eter ini diklasifikasikan sebagai ahli etil dialkyl; iaitu, mereka mempunyai formula ROR ', di mana R dan R' mewakili segmen karbon yang berlainan. Dan kerana ia menggambarkan nama tengahnya, dietil eter, adalah dua radikal-etil yang mengikat atom oksigen.

Pada mulanya, etil eter digunakan sebagai anestetik umum, diperkenalkan pada tahun 1846 oleh William Thomas Green Morton. Walau bagaimanapun, disebabkan oleh mudah terbakar, kegunaannya ditolak, menggantikannya dengan anestesi yang kurang berbahaya..
Kompaun ini juga telah digunakan untuk menganggarkan masa peredaran darah, semasa penilaian status kardiovaskular pesakit.
Di dalam badan, dietil eter boleh diubah menjadi karbon dioksida dan metabolit; yang akhirnya akan diekskresikan dalam air kencing. Walau bagaimanapun, kebanyakan ether yang ditadbir dikeluarkan di dalam paru-paru, tanpa menjalani pengubahsuaian.
Sebaliknya, ia digunakan sebagai pelarut untuk sabun, minyak, minyak wangi, alkaloid dan gusi.
Indeks
- 1 Struktur etil eter
- 1.1 Angkatan intermolecular
- 2 Sifat fizikal dan kimia
- 2.1 Nama lain
- 2.2 Rumus molekul
- 2.3 Berat molekul
- 2.4 Penampilan fizikal
- 2.5 Bau
- 2.6 Rasa
- 2.7 Titik didih
- 2.8 Tahap lebur
- 2.9 Titik kilat
- 2.10 Kelarutan dalam air
- 2.11 Keterlarutan dalam cecair lain
- 2.12 Ketumpatan
- 2.13 Ketumpatan wap
- 2.14 Tekanan wap
- 2.15 Kestabilan
- 2.16 Pencucuhan auto
- 2.17 Penguraian
- 2.18 Kelikatan
- 2.19 Haba pembakaran
- 2.20 Haba pengewapan
- 2.21 Ketegangan permukaan
- 2.22 Potensi ionisasi
- 2.23 Ambang ambang
- 2.24 Indeks indeks
- 3 Mendapatkan
- 3.1 Dari alkohol etil
- 3.2 Dari etilena
- 4 Ketoksikan
- 5 Kegunaan
- 5.1 Pelarut organik
- 5.2 Anestesia am
- 5.3 Roh eter
- 5.4 Penilaian peredaran darah
- 5.5 Makmal pengajaran
- 6 Rujukan
Struktur etil eter
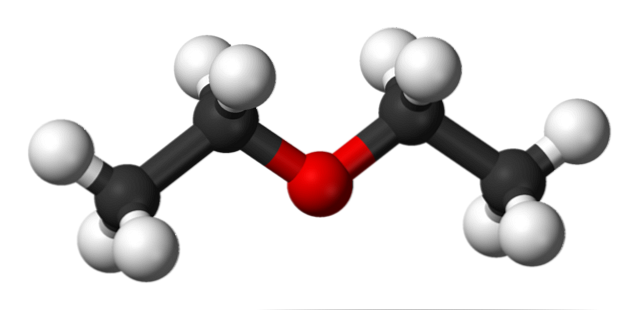
Dalam imej di atas kita mempunyai representasi dengan model sfera dan bar struktur molekul etil eter.
Seperti yang dapat dilihat, sfera merah, bersamaan dengan atom oksigen, mempunyai dua kumpulan etil yang dihubungkan pada kedua-dua belah pihak. Semua pautan adalah mudah, fleksibel, dan bebas berputar di sekeliling paksi σ.
Pewarisan ini berasal dari stereoisomer yang dikenali sebagai conformers; bahawa lebih daripada isomer, ia adalah keadaan ruang alternatif. Struktur imej sepadan dengan tepat dengan anti penentukuran, di mana semua kumpulan atomnya terhuyung-huyung (terpisah dari satu sama lain).
Apa yang akan menjadi pengubah yang lain? Yang terkuras, dan walaupun imej anda tidak tersedia, hanya menggambarkannya dengan bentuk U. Di hujung atas U akan terletak kumpulan metil, -CH3, yang akan mengalami penolakan sterik (mereka akan bertembung di angkasa).
Oleh itu, diharapkan molekul CH3CH2OCH2CH3 mengamalkan penyesuaian anti sebahagian besar masa.
Daya intermolecular
Dengan apa daya antara molekul molekul etil eter dikawal dalam fasa cair? Mereka dikekalkan dalam cecair terutamanya terima kasih kepada daya penyebaran, kerana momen kepang mereka (1.5D) tidak mempunyai rantau yang cukup kekurangan kepadatan elektronik (δ +)
Ini kerana tiada atom karbon dari kumpulan etil memberikan ketumpatan elektron terlalu banyak kepada atom oksigen. Di atas adalah jelas dengan peta potensi elektrostatik etil eter di tangan (imej bawah). Perhatikan ketiadaan kawasan biru.
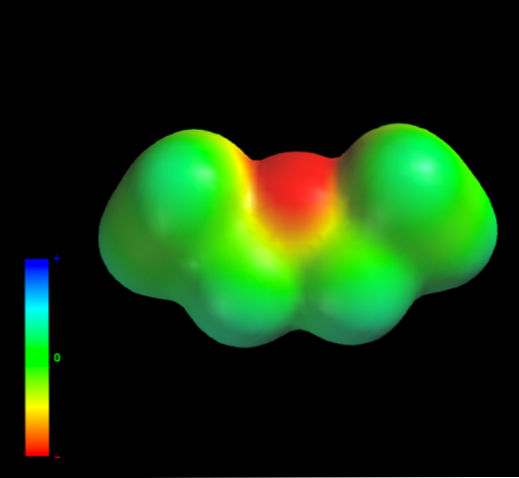
Oksigen tidak boleh membentuk ikatan hidrogen sama ada, sekali lagi, kerana tidak ada ikatan O-H dalam struktur molekul. Oleh itu, ia adalah dipol seketika dan jisim molekul mereka yang memihak kepada kekuatan penyebaran mereka.
Walaupun begitu, ia sangat larut dalam air. Mengapa? Kerana atom oksigennya, dengan kepadatan elektron yang lebih tinggi, dapat menerima ikatan hidrogen dari molekul air:
(CH3CH2)2Oδ- - δ+H-OH
Interaksi ini bertanggungjawab untuk 6.04g ether ini larut dalam 100mL air.
Sifat fizikal dan kimia
Nama lain
-Dietil eter
-Ethoxyethane
-Etil oksida
Formula molekul
C4H10O atau (C2H5)2O.
Berat molekul
74.14 g / mol.
Penampilan fizikal
Cecair tidak berwarna.
Bau
Manis dan pedas.
Rasa
Membakar dan manis.
Titik didih
94.3 ºF (34.6 ºC) hingga 760 mmHg.
Titik lebur
-177.3 ºF (-116.3 ªC). Kristal yang stabil.
Titik pencucuhan
-49ºF (bekas tertutup).
Kelarutan dalam air
6.04 g / 100mL pada 25 ºC.
Kelarutan dalam cecair lain
Berlainan dengan alkohol aliphatik pendek, benzena, kloroform, eter petroleum, pelarut lemak, banyak minyak dan asid hidroklorik pekat.
Larut dalam aseton dan sangat larut dalam etanol. Ia juga larut dalam naphtha, benzena dan minyak.
Ketumpatan
0.714 mg / mL pada 68 ªF (20 ºC).
Ketumpatan wap
2.55 (berhubung dengan udara yang diambil dengan ketumpatan 1).
Tekanan wap
442 mmHg pada 68ºF. 538 mmHg pada 25 ° C. 58.6 kPa pada 20 ºC.
Kestabilan
Ia secara perlahan dioksidakan oleh tindakan udara, kelembapan dan cahaya dengan pembentukan peroksida.
Pembentukan peroksida boleh berlaku dalam bekas eter yang telah dibuka dan yang disimpan di dalam simpanan selama lebih dari enam bulan. Peroksida boleh meletup akibat geseran, kesan atau pemanasan.
Elakkan sentuhan dengan: zink, halogens, oxyhalides bukan logam, agen pengoksidaan yang kuat, kromil klorida, minyak mentah, nitrat dan klorida logam.
Pencucuhan auto
356ºF (180ºC).
Penguraian
Apabila pemanasan itu terurai, mengeluarkan asap pedas dan menjengkelkan.
Kelikatan
0.2448 cPoise pada 20ºC.
Haba pembakaran
8,807 Kcal / g.
Haba pengewapan
89.8 cal / g pada 30ºC.
Ketegangan permukaan
17.06 dynes / cm pada 20º C.
Potensi ionisasi
9.53 eV.
Ambang ambang
0.83 ppm (kesucian tidak diberikan).
Indeks refraktif
1,355 pada 15ºC.
Mendapatkan
Dari etil alkohol
Etil eter boleh diperolehi daripada etil alkohol, dengan kehadiran asid sulfurik sebagai pemangkin. Asid sulfurik dalam larutan medium berair menghasilkan ion hidronium, H3O+.
Alir etil anhydrous mengalir melalui larutan asid sulfurik, dipanaskan antara 130 ° C dan 140 ° C, menghasilkan protonasi molekul etil alkohol. Selanjutnya, molekul lain etil alkohol yang tidak proton bereaksi dengan molekul protonasi.
Apabila ini berlaku, serangan nucleophilic molekul kedua etil alkohol menggalakkan pembebasan air dari molekul pertama (protonated one); akibatnya, etil eter protonated terbentuk (CH3CH2OHCH2CH3), dengan positif positif oksigen yang dikenakan.
Walau bagaimanapun, kaedah sintesis ini kehilangan kecekapan kerana asid sulfurik dicairkan dengan air yang dihasilkan dalam proses (produk dehidrasi etil alkohol).
Suhu tindak balas adalah kritikal. Pada suhu di bawah 130 ° C, tindak balas adalah perlahan dan sebahagian besar etil alkohol akan disuling.
Di atas 150 ° C, asid sulfurik menyebabkan pembentukan etilena (alkena ikatan berganda), bukannya menggabungkan dengan etil alkohol untuk membentuk etil eter.
Dari etilena
Dalam proses yang bertentangan, iaitu penghidratan etilena dalam fasa wap, etil eter boleh dibentuk sebagai produk sampingan sebagai tambahan kepada etil alkohol. Sebenarnya, laluan sintetik ini menghasilkan kebanyakan sebatian organik ini.
Proses ini menggunakan pemangkin asid fosforik yang tetap dengan sokongan padu, mampu menyesuaikan diri untuk menghasilkan lebih banyak eter.
Dehidrasi dalam fasa wap etanol dengan kehadiran pemangkin alumina, boleh memberikan hasil 95% dalam pengeluaran etil eter.
Ketoksikan
Ia boleh menyebabkan kerengsaan pada kulit dan mata dengan sentuhan. Hubungan dengan kulit boleh menyebabkan pengeringan dan retak. Eter tidak biasanya menembus kulit, kerana ia cepat menguap.
Kerengsaan mata yang disebabkan oleh eter biasanya ringan, dan dalam keadaan kerengsaan teruk, kerosakan biasanya boleh diterbalikkan.
Penyerapannya menghasilkan kesan narkotik dan kerengsaan perut. Pengingesan yang teruk boleh menyebabkan kerosakan buah pinggang.
Penyedutan eter boleh menyebabkan kerengsaan hidung dan tekak. Dalam hal penyedutan eter boleh terjadi: mengantuk, keseronokan, pening, muntah, pernafasan yang tidak teratur dan peningkatan air liur.
Pendedahan yang tinggi boleh menyebabkan kehilangan kesedaran dan juga kematian.
OSHA menetapkan had pendedahan pekerjaan sebanyak 800 ppm secara purata semasa peralihan 8 jam.
Tahap kerengsaan mata: 100 ppm (manusia). Tahap kerengsaan mata: 1200 mg / m3 (400 ppm).
Kegunaan
Pelarut organik
Ia adalah pelarut organik yang digunakan untuk membubarkan bromin, yodium dan halogen lain; kebanyakan lipid (lemak), resin, karet tulen, beberapa alkaloid, gusi, minyak wangi, selulosa asetat, selulosa nitrat, hidrokarbon dan pewarna.
Di samping itu, ia digunakan dalam pengekstrakan prinsip aktif tisu haiwan dan tumbuh-tumbuhan, kerana ia mempunyai ketumpatan yang lebih rendah daripada air dan terapung di atasnya, meninggalkan bahan-bahan yang diinginkan yang dibubarkan dalam eter.
Anestesia am
Ia telah digunakan sebagai anestetik am sejak 1840, menggantikan kloroform kerana mempunyai kelebihan terapeutik. Walau bagaimanapun, ia adalah bahan yang mudah terbakar, dan oleh itu, menghadapi masalah yang teruk untuk digunakan dalam tetapan klinikal.
Di samping itu, ia menghasilkan pada pesakit beberapa kesan sampingan selepas operasi seperti mual dan muntah.
Atas alasan ini, penggunaan ether sebagai anestetik umum telah dibuang, menggantikannya dengan anestetik lain seperti halothane..
Roh eter
Eter yang dicampur dengan etanol digunakan untuk membentuk penyelesaian yang dipanggil semangat eter, yang digunakan dalam rawatan perut kembung dan bentuk gastralgia yang lebih ringan.
Penilaian peredaran darah
Eter telah digunakan untuk menilai peredaran darah antara lengan dan paru-paru. Eter disuntik ke dalam lengan, membawa darah ke atrium kanan, kemudian ke ventrikel kanan dan dari sana ke paru-paru.
Masa yang berlaku dari suntikan eter, untuk pengambilan bau eter dalam udara yang dikeluarkan, adalah kira-kira 4 hingga 6 s.
Makmal mengajar
Ether digunakan dalam mengajar makmal dalam banyak eksperimen; sebagai contoh, dalam demonstrasi undang-undang genetik dari Mendel.
Eher digunakan untuk meredakan lalat genus Drosophila dan membenarkan lintasan yang diperlukan di antara mereka, untuk membuktikan undang-undang genetik
Rujukan
- Graham Solomons T.W, Craig B. Fryhle. (2011). Kimia Organik. Amines (10th edisi.). Wiley Plus.
- Carey F. (2008). Kimia Organik (Edisi keenam). Mc Graw Hill.
- The Sevier. (2018). Dietil eter. Sains Terus. Diperolehi daripada: sciencedirect.com
- The Editors of Encyclopaedia Britannica. (2018). Etil eter. Britannica ncyclopædia. Diperolehi daripada: britannica.com
- PubChem (2018). Ether. Diperolehi daripada: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Dietil eter. Diperolehi daripada: en.wikipedia.org
- Lembaran keselamatan XI: etil eter. [PDF] Pulih daripada: quimica.unam.mx


